(10分)如图所示,水槽中试管内有一枚铁钉,放置数天观察:
(1)铁钉在逐渐生绣。
(2)若试管内液面上升,发生 腐蚀,电极反应:负极: ,正极: 。
(3)若试管内液面下降,则原溶液呈 性,发生的电极反应:正极: 。
常温下由三种短周期元素形成的气体单质X、Y、Z,并有下列转化关系(反应条件已略去):
已知:X分子中含共价键最多;甲分子中含10个电子,乙分子含有18个电子。
(1)写出单质X的结构式是__________________________________;
(2)化合物甲的电子式是____________________________________;
(3)化合物丙中存在的作用力是______________________________。
在一只试管中放入几小块镁片,把试管放入盛有25 ℃的饱和石灰水的烧杯中,用胶头滴管滴5 mL盐酸于试管中。试回答下列问题:
(1)实验中产生的现象是________________________________________。
(2)产生上述现象的原因是______________________________________。
(3)写出有关的离子方程式:____________________________________。
(4)由实验推知:MgCl2溶液与H2的总能量________(填“<”“>”或“=”)镁片和盐酸的总能量。
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示: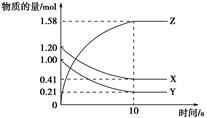
(1)从反应开始到10 s,用Z表示的反应速率为______。X的物质的量浓度减少了______,Y的转化率为_____________________________________。
(2)该反应的化学方程式为:____________________________________________。
A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。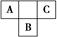
(1)A、B、C三种元素的名称分别为________、________、________。
(2)B位于元素周期表中第______周期,第________族。
(3)C的原子结构示意图为________,C的单质与H2反应的化学方程式为_________________________________________________________________。
(4)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式_______________________________________________________________。
某含氧有机物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%,其余为氧。
(1)X的分子式是________。
(2)X能与金属钠反应放出氢气,则X结构中含有的官能团的名称为________。
(3)X与空气中的氧气在催化剂作用下反应生成了Y,该反应的化学方程式是______________________,反应类型为________。
(4)X与高锰酸钾酸性溶液反应可生成Z,在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W,若184 g X和120 g Z反应生成132 g W,该反应的化学方程式为____________________________,其中X的转化率为________。