室温时,下列混合溶液的pH一定小于7的是
| A.pH=3的盐酸和pH=11的氨水等体积混合 |
| B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合 |
| C.pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合 |
| D.pH=3的硫酸和pH=11的氨水等体积混合 |
我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9 m)恢复了磁性。“钴酞菁”分子的结构和性质与人体内的血红素及植物休内的叶绿素非常相似。下列说法中不正确的是()
| A.“钴酞菁”分子所形成的分散系不具有丁达尔效应 |
| B.“钴酞菁”分子能透过滤纸 |
| C.此项工作可以用来改变分子的某些物理性质 |
| D.此项工作可广泛应用于光电器件、生物技术等方面 |
下列叙述正确的是
| A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2] < c[(NH4)2SO4] < c(NH4Cl) |
| B.无色透明的酸性溶液中,Cu2+、K+、SO42-、NO3-能大量共存 |
| C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH=1 |
| D.NaHCO3溶液中:c(H+) + c(H2CO3)=c(CO32-) + c(OH-) |
“甲型H1N1”流感疫情已构成“具有国际影响的公共卫生紧急事态”。已知扎那米韦是流感病毒神经氨酸酶抑制剂,其对流感病毒的抑制是以慢结合的方式进行的,具有高度特异性,其分子结构如图所示。
下列说法正确的是
| A.该物质的分子式为C12H20N4O7 |
| B.1mol该物质与NaOH溶液反应,可以消耗4molNaOH |
| C.在一定条件下,该物质可以发生消去、加成、取代等反应 |
| D.该物质能使溴水或高锰酸钾溶液褪色,能与FeCl3溶液发生显色反应 |
下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43-+2I-+2H+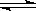 AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。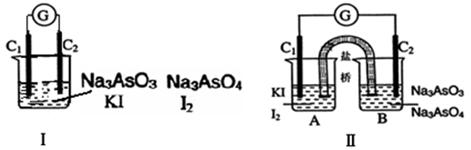
下列叙述中正确的是
| A.甲组操作时,微安表(G)指针发生偏转 |
| B.甲组操作时,溶液颜色变深 |
| C.乙组操作时,C2做正极 |
| D.乙组操作时,C1上发生的电极反应为I2 +2e-=2I- |
在溶液中有浓度均为0.01mol·L-1的Fe3+、Cr3+、Zn2+、Mf2+等离子,已知:
Ksp[Fe(OH)3]=2.6×10-39;Ksp[Cr(OH)3]=7.0×10-31
Ksp[Zn(OH)2]=1.0×10-17;Ksp[Mg(OH)2]=1.8×10-11
当氢氧化物开始沉淀时,下列哪一种离子所需溶液的pH最小
| A.Fe3+ | B.Cr3+ | C.Zn2+ | D.Mg2+ |