下图中X、Y分别是直流电源的两极,通电后发现a电极质量增加,b电极处有无色无味气体放出。符合这一情况的是表中的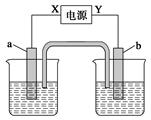
 |
a |
b |
X |
溶液 |
| A |
锌 |
石墨 |
负极 |
CuSO4 |
| B |
石墨 |
石墨 |
负极 |
NaOH |
| C |
银 |
铁 |
正极 |
AgNO3 |
| D |
铜 |
石墨 |
负极 |
CuCl2 |
下列叙述中,正确的是
A. 含金属元素的离子一定都是阳离子
B. 现代化学分析测试中,常借助一些仪器来分析化学物质组成。例如,可用元素分析仪确定C、H、O等元素,用红外光谱仪确定物质中的有机原子团,用原子吸收光谱确定物质中含有哪些非金属元素
C. 某元素从化合态变为游离态时,该元素一定被还原
D. 金属阳离子被还原不一定得到金属单质
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.常温常压下,0.1molCl2溶于水,Cl2与水发生反应转移的电子数目为0.1NA |
| B.常温常压下,0.2molAl与足量NaOH溶液反应,转移电子数为0.6 NA |
| C.常温常压下,500 mL 0.1mol/L醋酸溶液中含有分子的总数目为0.05NA |
| D.常温常压下,16g CH4与18 g NH4+所含质子数相等 |
下列说法正确的是
| A.萃取操作时,振荡过程中需要放气,放气是通过打开分液漏斗上口的玻璃塞进行的 |
| B.可以采用蒸发浓缩、冷却结晶的方法从硝酸钾溶液中获得硝酸钾晶体 |
| C.将乙醇与水分离,如图1、图2操作 |
| D.稀释浓H2SO4,如图3操作 |
下列溶液中溶质的物质的量浓度为1mol/L的是()
| A.将58.5gNaCl溶解在1L水中 |
| B.将1L10mol/L的浓盐酸加入9L水中 |
| C.将22.4LHCl气体溶于水配成1L溶液 |
| D.将10gNaOH溶解在少量水中,再加蒸馏水直到溶液体积为250mL |
水资源非常重要,联合国确定2003年为国际淡水年。海水淡化是海岛地区提供淡水的重要手段,所谓海水淡化是指除去海水中的盐分以获得淡水的工艺过程(又称海水脱盐),其方法较多,如反渗透法、水合物法、电渗透法、离子交换法和压渗法等。下列方法中也可以用来进行海水淡化的是()
| A.过滤法 | B.蒸馏法 | C.分液法 | D.冰冻法 |