下列有关金属腐蚀与防护的说法正确的是
| A.银器表面在空气中因电化腐蚀渐渐变暗 |
| B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
已知H2(g)+Br2(l)=2HBr(g);△H=-72KJ/mol,蒸发1mol Br2(l)需要吸收的能量为30KJ,其他的相关数据如右表:
则表中a为
| A.404 | B.260 | C.230 | D.200 |
右图是373K时N2与H2反应过程中能量变化的曲线图。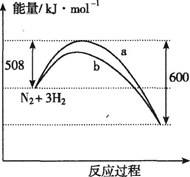
下列叙述正确的是
A.该反应的热化学方程式为:N2+3H2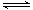 2NH3 △H=-92kJ·mol-1 2NH3 △H=-92kJ·mol-1 |
| B.a曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热不变 |
| D.在温度体积一定的条件下,通入1mol N2和3 mol H2反应后放出的热量为Q1kJ,若通入 2 mol N2和6mol H2反应后放出的热量为Q2kJ则184>Q2=2Q1 |
高温下,某反应达平衡,平衡常数K= 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
| A.恒温恒容下,增大压强,H2浓度一定减小 | B.该反应的焓变为正值 |
| C.该反应化学方程式为CO+H2O=CO2+H2 | D.升高温度,逆反应速率减小 |
根据碘与氢气反应的热化学方程式I2(g)+ H2(g)  2HI(g) △H=- 9.48 kJ·mol-1
2HI(g) △H=- 9.48 kJ·mol-1
(ii) I2(s)+ H2(g) 2HI(g) △H= +26.48kJ·mol-1下列判断正确的是
2HI(g) △H= +26.48kJ·mol-1下列判断正确的是
| A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ |
| B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C.反应(i)的产物比反应(ii)的产物稳定 |
| D.反应(ii)的反应物总能量比反应(i)的反应物总能量低 |
如下图所示,左侧注射器吸入10mLNO2、N2O4的混合气体,右侧注射器吸入10mL空气,且U型管内两侧液面保持水平位置(液体不与气体反应),现将两侧注射器活塞同时快速向内推到5mL,下列说法不正确的是(忽略温度变化)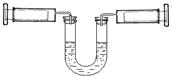
| A.压缩后U型管内两侧液面仍然保持水平 |
B.对于2NO2 N2O4平衡体系,向生成N2O4的方向移动 N2O4平衡体系,向生成N2O4的方向移动 |
| C.左侧气体颜色先变深后逐渐变浅(比原来深) |
| D.若将两侧注射器活塞重新拉到10mL的位置,平衡后U型管两侧液面仍然保持水平 |