下列实验中,依据实验操作及现象得出的结论正确的是
| |
操 作 |
现 象 |
结 论 |
| A |
测定等浓度的Na2CO3和Na2SO3 溶液的pH |
前者pH比后者的大 |
非金属性:S>C |
| B |
无色溶液中滴加氯水和CCl4,振荡、静置 |
下层溶液显紫色 |
原溶液中有I- |
| C |
向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 |
生成白色沉淀 |
溶液X中一定含有CO32—或HCO3— |
| D |
向某无色溶液中滴加硝酸酸化的BaCl2溶液 |
产生白色沉淀 |
溶液中可能含有Ag+ |
常温下,pH=13的强碱溶液和pH=2的强酸溶液混合,所得溶液的pH=11,则强碱溶液和强酸溶液的体积之比为
| A.11:1 | B.9:1 | C.1:11 | D.1:9 |
把0.05 mol NaOH固体分别加入到100 mL下列液体中,溶液的导电能力变化最小的是
| A.自来水 | B.0.5 mol·L-1的盐酸 |
| C.0.5 mol·L-1的CH3COOH溶液 | D.0.5 mol·L-1的KCl溶液 |
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
| 酸 |
HClO4 |
H2SO4 |
HCl |
HNO3 |
| Ka |
1.6×10-5 |
6.3×10-9 |
1.6×10-9 |
4.2×10-10 |
从以上表格中判断以下说法中不正确的是
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4===2H++SO42-
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四种酸的强弱
常温下,若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是
| A.Al3+ Na+NO3- Cl- | B.K+ Na+Cl- NO3- |
| C.K+ Na+ Cl-AlO2- | D.K+ NH4+SO42-NO3- |
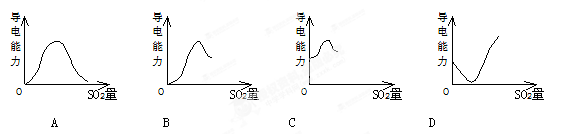
下列图中,能正确表示饱和H2S溶液中通入过量SO2后溶液导电情况的是