NA代表阿伏加德罗常数,下列说法正确的是
| A.0.1 molNa2O2与足量的CO2充分反应转移的电子数为0.2NA |
| B.0.1 mol铁在0.1 mol Cl2中充分燃烧,有0.2NA个电子转移 |
| C.1L 1mol·L-1的CH3COOH溶液中含有NA个氢离子 |
D.VLCO和NO的混合气体中含有的氧原子个数为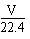 NA NA |
【改编】二甲醚(CH3OCH3)是一种绿色、可再生的新能源。下图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性Pt电极)。该电池工作时,下列说法正确的是
| A.a电极为该电池正极 |
| B.O2在b电极上得电子,被氧化 |
| C.电池工作时,a电极反应式:CH3OCH3—12e-+3H2O = 2CO2↑+12H+ |
| D.电池工作时,燃料电池内部H+从b电极移向a电极 |
【原创】下列叙述正确的是
| A.37Cl2含有40个中子 |
| B.在一定的条件下,1摩尔氮气和3摩尔氢气反应能生成2摩尔氨气 |
| C.增大压强,反应速率一定加快 |
| D.放热反应肯定不需要加热就能反应 |
【原创】实验室用3.0 mol·L-1的硫酸溶液与锌粒反应制取氢气。下列措施中可能加大反应速率的是
| A.适当降低温度 |
| B.将锌粒改为锌粉 |
| C.将所用硫酸换成98%的浓硫酸 |
| D.加入少量醋酸钠固体 |
铜~锌原电池如图所示,电解质溶液为稀硫酸,下列说法不正确的是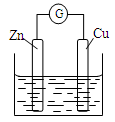
| A.铜电极上发生还原反应 |
| B.锌电极是原电池的负极 |
| C.电子从铜极经过外电路流向锌极 |
| D.锌电极上的反应为Zn-2e— ="=" Zn2+ |
【改编】以下各分子中,所有原子都满足最外层为8电子结构的是
| A.H2O | B.BCl3 | C.SO2 | D.PCl3 |