三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化。制备三氯化铬的流程如下图所示:
(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤,如何用简单方法判断其已洗涤干净? 。
(2)已知CCl4沸点为76.8℃,为保证稳定的CCl4气流,适宜的加热方式是 。
(3)用下图装置制备CrCl3时,
反应管中发生的主要反应为: Cr2O3+3CCl4==2CrCl3+3COCl2,则向三颈烧瓶中通入N2的作用为:
① ;
② 。
(4)样品中三氯化铬质量分数的测定:称取样品0.3000g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1g Na2O2,充分加热煮沸,适当稀释,然后加入过量2mol·L–1H2SO4至溶液呈强酸性,此时铬以Cr2O72–存在,再加入1.1g KI,加塞摇匀,充分反应后铬以Cr3+存在,于暗处静置5min后,加入1mL指示剂,用0.0250mol·L–1标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液21.00mL。(已知:2Na2S2O3+I2 == Na2S4O6+2NaI)
①滴定实验可选用的指示剂名称为 ,判定终点的现象是 ;若滴定时振荡不充分,刚看到局部变色就停止滴定,则会使样品中无水三氯化铬的质量分数的测量结果 (填“偏高”“偏低”或“无影响”)。
②加入Na2O2后要加热煮沸,其主要原因是 。
③加入KI时发生反应的离子方程式为 。
④样品中无水三氯化铬的质量分数为 。(结果保留一位小数)
白玉的化学式可用CaxMgySipO22(OH)2表示(也可用Ca、Mg、Si、H的氧化物表示)。
(1)取8.10g白玉粉末灼烧至恒重,固体减少了0.18g,则白玉的摩尔质量为____________g/mo1。
(2)另取4.05g白玉粉末加入lmol/L的盐酸l00mL中充分溶解,得不溶物2.40g。过滤,将滤液和洗涤液合并后往其中加入足量的铁屑,得到气体336mL(STP)。则
①p=_______;②白玉的化学式为______________________________。
(13分)已知: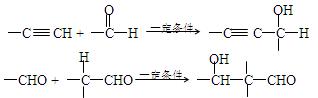
以乙炔为原料,通过下图所示步骤能合成有机物中间体E(转化过程中的反应条件及部分产物已略去)。
其中,A、B、C、D分别代表一种有机物;B的化学式为C4H10O2,分子中无甲基。
请回答下列问题:
(1)A→B的化学反应类型是。
(2)写出生成A的化学方程式: 。
。
(3)B在浓硫酸催化下加热,可生成多种有机物。写出2种相对分子质量比A小的有机物的结构简式:
、。
(4)写出C生成D的化学方程式:。
(5)含有苯环,且与E互为同分异构体的酯有种,写出其中二种同分异构体的结构简式:。
有机物A,俗称水杨酸,其结构简式为:
已知:
(1)将A跟下列物质的溶液反应可以得到一种钠盐(其化学式为C7H5O3Na)是
。
A.NaOH B.Na2CO3 C.NaHCO3 D.NaCl
(2)水杨酸的同分异构体中,属于酚类,同时还属于酯类的化合物有种,其结构简式分别为。
(3)水杨酸的同分异构体中,属于酚类,但不属于酯类,也不属于羧酸类的化合物一定含有基(填写除了羟基以外的官能团名称)
(4)水杨酸在酸性条件下与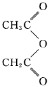 反应合成阿司匹林,则阿司匹林的结构为。可以检验阿司匹林样品中混有水杨酸的试剂是。
反应合成阿司匹林,则阿司匹林的结构为。可以检验阿司匹林样品中混有水杨酸的试剂是。
A.三氯化铁溶液 B.碳酸氢钠 C.石蕊试液
工业制硝酸的主要反应是:4NH3(g)+5O2(g)  4NO(g)+6H2O (g)+1025 kJ
4NO(g)+6H2O (g)+1025 kJ
(1)该反应的平衡常数表达式为K=________________;升高温度K值__________ (填“增大”、“减小”或“不变”)。
(2)若反应物起始的物质的量相同,下列关系图错误的是________ (填字母序号)。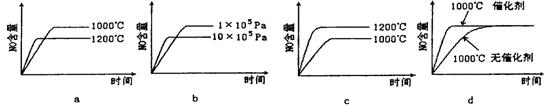
(3)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 |
c(NH3)(mol/L) |
C(O2)(mol/L) |
C(NO)(mol/L) |
| 起始 |
0.8 |
1.6 |
0 |
| 第2min |
0.6 |
a |
0.2 |
| 第4min |
0.3 |
0.975 |
0.5 |
| 第6min |
0.3 |
0.975 |
0.5 |
| 第8min |
0.8 |
1.6 |
0.5 |
①起始时物料比c (O2):c (NH3)>1.25,其原因是_________________________。
②反应在第2min到第4min时O2的平均反应速率为______________ mol/L·min;
③反应在第2min改变了反应条件,改变的条件可能是 ________ (填字母序号)。
a.使用催化剂 b.升高温度 c.增大压强 d.增加O2的浓度
④反应在第8min改变的反应条件可能是_______________________________。
亚硫酸 钠和碘酸钾在酸性溶液中发生以下发应:
钠和碘酸钾在酸性溶液中发生以下发应:
Na2SO3+KIO3+H2SO4 → __Na2SO4 +K2SO4+I2 +
(1)配平上面的方程式,在横线上填入系数,在方框填上反应产物
(2)其中氧化剂是,若反应中有2.5mol电子转移,则生成的碘是mol;氧化产物为mol。
(3)该反应的过程和机理较复杂,一般认为发生以下四步反应:
① IO3- +SO32 - IO2- + SO42 - (反应速率慢)
IO2- + SO42 - (反应速率慢)
② IO2- + 2SO32 - I- + 2SO42 - (反应速率快)
I- + 2SO42 - (反应速率快)
③ 5I- +6H+ +IO3- 3I2 +3H2O(反应速率快)
3I2 +3H2O(反应速率快)
④ I2 +SO32 - +H2O I- + SO42 -+2H+(反应速率快)
I- + SO42 -+2H+(反应速率快)
根据上述步骤推测该反应总的反应速率由_____(填反应编号)步反应决定。
(4)预先加入淀粉溶液,由上述四步反应可以看出必须在_____离子消耗完后,才会使淀粉变蓝的现象产生。