下列离子方程式正确的是
| A.Fe和稀硫酸反应:2Fe+6H+== 2Fe3++3H2↑ |
| B.Na2O2溶于水产生O2:Na2O2+H2O == 2Na++2OH–+O2↑ |
C.用石墨做电极电解饱和MgCl2溶液:2Cl–+2H2O Cl2↑+H2↑+2OH– Cl2↑+H2↑+2OH– |
| D.强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:4OH–+3ClO–+2Fe (OH)3 == 2FeO42–+3Cl–+5H2O |
化学在工业生产和日常生活中有着重要的应用。下列说法正确的是
| A.CO2、NO2和SiO2都是酸性氧化物,都是大气污染物 |
| B.Na2O2、H2O2所含化学键完全相同,都能作供氧剂 |
| C.常温下,浓硫酸、浓硝酸与铁均能发生钝化,均能用铁罐储运 |
| D.NaClO和明矾都能作消毒剂或净水剂,加入酚酞试液均显红色 |
图表归纳是学习化学的一种常用方法,某同学归纳的下表与图中对应关系正确的是
| 选项 |
X |
Y |
Z |
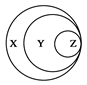 |
| A |
胶体 |
混合物 |
淀粉溶液[ |
|
| B |
化合物 |
酸性氧化物 |
一氧化氮 |
|
| C |
气态氢化物 |
化合物 |
液溴 |
|
| D |
强电解质 |
强酸 |
硫酸 |
设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.25℃和101kp的条件下,4.9L甲烷完全燃烧生成的水的分子数为0.4NA |
| B.用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA |
| C.Na2O2与足量H2O反应生成标况下11.2LO2,转移电子的数目为2 NA |
| D.标准状况下,2.24LHF中所含电子数为NA |
含有下列各组离子的溶液中,通入过量SO2气体后仍能大量共存的是
| A.H+、Ca2+、Fe3+、NO3- | B.Ba2+、Cl-、Al3+、H+ |
| C.K+、NH4+、I-、HS- | D.Na+、CO32-、K+、NO3- |
下列说法正确的是
| A.溶液是电中性的,胶体是带电的 |
| B.通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动 |
| C.依据丁达尔效应可将分散系分为溶液、胶体与浊液 |
| D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 |