液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如下图装置①。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列叙述不正确的是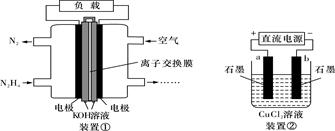
| A.该燃料电池负极发生的电极反应为:N2H4+4OH--4e-===N2+4H2O |
| B.用该燃料电池作为装置②的直流电源,产生1 mol Cl2至少需要通入0.5 mol N2H4 |
| C.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 |
| D.该燃料电池中,电子从右侧电极经过外电路流向左侧电极,溶液中OH-则迁移到左侧 |
科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。该电池负极反应为
| A.H2+2OH-=2H2O+2e- | B.O2+4H++4e-=2H2O |
| C.H2=2H++2e- | D.O2+2H2O+4e-=4OH- |
下列有关化学方应方向的说法中正确的是
| A.凡是焓变小于零的反应都能自发进行 |
| B.凡是熵变小于零的化学反应都能自发进行 |
| C.凡是焓变小于零,熵变大于零的化学变化都能自发进行 |
| D.CaCO3在高温下的分解反应不属于自发过程 |
a mol FeS与b mol FeO投入到V L、c mol·L-1的稀硝酸溶液中充分反应,产生NO气体,所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )
如图I所示,甲、乙之间的隔板K和活塞F都可以左右移动,甲中充入2 molA和1 mol B,乙中充入2 mol C和1 mol He,此时K停在0处。在一定条件下发生反应:2A(g)+B(g) 2C(g),反应达到平衡后,再恢复至原温度,则下列说法正确的是
2C(g),反应达到平衡后,再恢复至原温度,则下列说法正确的是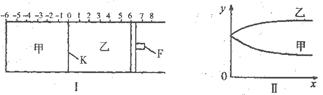
| A.达到平衡时,隔板K最终停留在刻度0与-2之间 |
| B.若达到平衡时,隔板K最终停留在刻度-l处,则乙中C的转化率小于50% |
| C.若达到平衡时,隔板K最终停留在靠近刻度-2处,则乙中F最终停留刻度大于4 |
| D.若图Ⅱ中x轴表示时间,则y轴可表示甲、乙两容器中气体的总物质的量或A的物质的量 |
下列溶液中有关物质的量浓度关系正确的是
| A.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合: c (Na+)>c (CH3COO-)>c(H+)>c(OH-) |
| B.向NH4HSO4溶液中滴加等物质的量的NaOH形成的溶液中: c(Na+) =c(SO42-) >c(NH4+) >c(H+) >c(OH-) |
| C.0.1 mol·L-1Na2CO3溶液与0.1mol·L-1NaHCO3,溶液等体积混合所得溶液: c(CO32-)+2c(OH-)=c(HCO3- )+c(H2CO3)+2c(H+) |
| D.相同温度下,pH相等的Na2CO3溶液、C6H5ONa(苯酚钠)溶液、NaOH溶液:c(C6H5ONa)>c(Na2CO3)>c(NaOH) |