(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3—。两步反应的能量变化示意图如下:
1 mol NH4+ (aq) 全部氧化成NO3—(aq)的热化学方程式是_______________。
(2)、电解NO制备 NH4NO3,其工作原理如图所示,
写出该电解池的电极反应式
阳极: __________________________ 阴极:________________________________
化学平衡移动原理同样也适用于其他平衡,已知在氨水中存在下列平衡:
NH3+H2O===NH3.H2O===NH4++OH-
(1)向氨水中加入MgCl2固体时,平衡向______________移动,OH-的浓度_______,
NH4+的浓度_______。
(2)向氨水中加入浓盐酸,此时溶液中浓度减小的微粒有_______、_______、_______。
(3)向浓氨水中加入少量的NaOH固体,平衡向_______移动,此时发生的现象是______________
______________。
对于溶液中进行的反应:FeCl3+3KSCN===Fe(SCN)3+3KCl,当其他条件一定时:
(1)向溶液中加入少量的KCl固体,溶液的颜色_______
(2)向溶液中加入少量KSCN固体,溶液的颜色_______
(3)加水稀释时,化学平衡向_______移动
在密闭容器中,当合成氨的反应N2+3H2===2NH3(正反应是放热反应)达到平衡时,改变如下的一些条件:
| A.升温, | B.加压, | C.减压, | D.增大c(H2),(E)减小c(NH3),(F)增大c(NH3),若平衡向右移动用“ →”,若平衡向左移动用“←”表示;若值增加用“↑”表示,若值减小用“↓”表示,请根据下表中各项的变化情况,在改变条件栏目中填上相应的编号(每项只改变一个条件)。 |
| 编号 |
改变条件 |
平衡移动方向 |
N2的转化率 |
C(NH3) |
C(N2) |
C(H2) |
| ① |
→ |
↑ |
↓ |
↓ |
↓ |
|
| ② |
← |
↓ |
↓ |
↑ |
↑ |
|
| ③ |
→ |
↑ |
↑ |
↓ |
↑ |
|
| ④ |
← |
↓ |
↓ |
↓ |
↓ |
|
| ⑤ |
→ |
↑ |
↑ |
↑ |
↑ |
对于反应:2SO2+O2===2SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入下表空格里(填“增大”、“减小”或“不变”)
| 编号 |
改变的条件 |
生成SO3的速率 |
| ① |
升高温度 |
|
| ② |
恒压下充入Ne |
|
| ③ |
增大O2的浓度 |
|
| ④ |
使用催化剂 |
|
| ⑤ |
压缩体积 |
|
| ⑥ |
恒容下充入Ne |
下图是利用石油为原料合成增塑剂G的基本流程: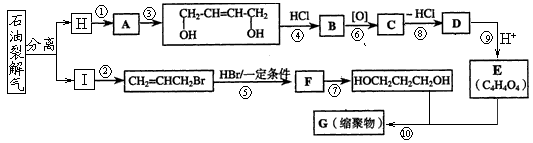
请完成下列各题:
(1)反应⑧条件是。
(2)写出反应⑦的化学方程式:。
(3)B被氧化成C的过程中会有中间产物生成,该中间产物可能是(写出一种物质的结构简式),检验该物质存在的试剂是。
(5)写出相对分子质最小,跟E互为同系物的有机物的结构简式_________________,写出G的结构简式。