元素周期律揭示了元素间的递变规律,下列递变规律正确的是
| A.第二周期元素氢化物稳定性:HF>H2O, 所以第三周期元素氢化物稳定性:HCl>H2S |
| B.ⅣA族元素氢化物沸点:SiH4 > CH4,所以ⅤA族元素氢化物沸点:PH3 > NH3 |
| C.ⅦA族元素的非金属性:F>Cl, 所以ⅦA族元素氢化物的酸性:HF>HCl |
| D.镁比铝活泼,工业上用电解熔融氧化铝,所以工业上也是电解熔融氧化镁制镁 |
水电解的化学方程式为2H2O 2H2↑+O2↑,某同学电解一定量的水,制得8 g H2,则该8 g H2的物质的量为( )
2H2↑+O2↑,某同学电解一定量的水,制得8 g H2,则该8 g H2的物质的量为( )
| A.2 mol | B.4 mol | C.8 mol | D.89.6 mol |
用NA表示阿伏德罗常数,下列叙述正确的是( )
| A.标准状况下,22.4LH2O含有的分子数为1 NA |
| B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
| C.通常状况下,1 NA 个CO2分子占有的体积为22.4L |
| D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1 NA |
在一定条件下,充分燃烧一定量的丁烷放出热量为Q kJ(Q>0),经测定完全吸收生成的CO2需消耗 5 mol·L-1的KOH溶液100 mL,恰好生成正盐,则此条件下反应C4H10(g)+O2(g)===4CO2(g)+5H2O(g)的ΔH为
| A.+8Q kJ·mol-1 | B.-16Q kJ·mol-1 |
| C.-8Q kJ·mol-1 | D.+16Q kJ·mol-1 |
根据盖斯定律判断如图所示的物质转变过程中正确的是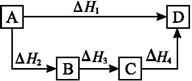
| A.ΔH1=ΔH2=ΔH3=ΔH4 | B.ΔH1+ΔH2=ΔH3+ΔH4 |
| C.ΔH1+ΔH2+ΔH3=ΔH4 | D.ΔH1=ΔH2+ΔH3+ΔH4 |
能源问题是人类社会面临的重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为-285.8 kJ·mol-1、-282.5 kJ·mol-1、-726.7 kJ·mol-1。已知CO和H2在一定条件下可以合成甲醇CO(g)+2H2(g)===CH3OH(l)。则CO与H2反应合成甲醇的热化学方程式为
| A.CO(g)+2H2(g)===CH3OH(g) ΔH=+127.4 kJ·mol-1 |
| B.CO(g)+2H2(g)===CH3OH(l) ΔH=+127.4 kJ·mol-1 |
| C.CO(g)+2H2(g)===CH3OH(g) ΔH=-127.4 kJ·mol-1 |
| D.CO(g)+2H2(g)===CH3OH(l) ΔH=-127.4 kJ·mol-1 |