二甲醚(CH3OCH3)是一种绿色、可再生的新能源。下图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性Pt电极)。该电池工作时,下列说法错误的是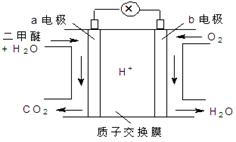
| A.a电极为该电池负极 |
| B.O2在b电极上得电子,被氧化 |
| C.电池工作时,a电极反应式:CH3OCH3—12e-+3H2O = 2CO2↑+12H+ |
| D.电池工作时,燃料电池内部H+从a电极移向b电极 |
下列苯的同系物中,苯环上的一溴化物只有一种的是
| A.乙苯 | B.邻二甲苯 | C.间二甲苯 | D.对二甲苯 |
下列有机物命名正确的是
| A.2,3,3-三甲基丁烷 | B.2-甲基-1-丁醇 |
| C.2-甲基-3-丁炔 | D.3,3-甲基-1-丁烯 |
能够快速、微量、精确的测定相对分子质量的物理方法是
| A.质谱法 | B.红外光谱法 | C.紫外光谱法 | D.核磁共振氢谱法 |
下列有关说法正确的是
| A.聚氯乙烯的单体是CH3CH2Cl |
| B.乙醇和乙二醇为同系物 |
| C.环己烷和丙烯的实验式相同 |
| D.正戊烷、异戊烷、新戊烷的沸点逐渐升高 |
下列有关说法不正确的是
| A.纤维素、油脂、蛋白质均为高分子化合物 |
| B.35%~40%的甲醛水溶液称为福尔马林,具有杀菌、防腐性能 |
| C.淀粉、溴乙烷、脂肪在一定条件下都可以发生水解反应 |
| D.脂肪烃的来源有石油、天然气和煤等,通过石油的裂化及裂解可得到气态烯烃 |