H2SO3是二元弱酸,NaHSO3溶液呈酸性。在0.1 mol·L-1 NaHSO3溶液中,下列关系正确的是
| A.c(HSO3—)>c(SO32—)>c(H2SO3) |
| B.c(Na+)=c(HSO3—)+2c(SO32—)+c(H2SO3) |
| C.c(Na+)=c(HSO3—)>c(H+)>c(OH-) |
| D.c(Na+)+c(H+)=c(HSO3—)+c(OH-)+c(SO32—) |
下列说法不正确的是
| A.探究温度对反应速率影响时,应先分别水浴加热硫代硫酸钠溶液、硫酸溶液到一定温度后再混合,不是先将两种溶液混合后再用水浴加热 |
| B.H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 |
| C.使用含有氯化钠的融雪剂会加快铁桥梁的腐蚀 |
| D.判断皂化反应是否完全,可取反应后的混合液滴入热水中 |
已知3.6g碳在6.4g氧气中燃烧,至反应物耗尽,共放出X kJ的热量。已知单质碳的燃烧热为Y kJ/mol,则1molC与O2反应生成CO的反应热△H为
| A.—Y kJ/mol | B.—(5X—0.5 Y) kJ/mol |
| C.—(10X—Y ) kJ/mol | D.+(10X—Y ) kJ/mol |
已知可逆反应aA+bB cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是
cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是
| A.该反应在T1、T3温度时达到化学平衡 |
| B.该反应在T2温度时未达到化学平衡 |
| C.升高温度,平衡会向正反应方向移动 |
| D.该反应的正反应是放热反应 |
反应mA(s)+nB(g)  pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如右图所示,下列叙述中一定正确的是
pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如右图所示,下列叙述中一定正确的是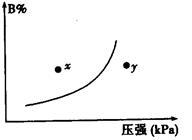
①m+n>p②x点表示的正反应速率大于逆反应速率
③n>p④x点比y点时的反应速率慢
⑤若升高温度,该反应的平衡常数增大
| A.①②⑤ | B.只有②④ |
| C.只有①③ | D.①③⑤ |
在体积固定的密闭容器中通入各为1mol的A、C、D和xmol B,发生反应:A(g)+4B(g) 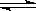 2C(g)+D(g)。当x在一定范围内变化时,均可以通过调节反应器的温度,使反应达到平衡时保持容器中气体总物质的量为5mol。若使起始反应向正方向进行,则x的取值范围是
2C(g)+D(g)。当x在一定范围内变化时,均可以通过调节反应器的温度,使反应达到平衡时保持容器中气体总物质的量为5mol。若使起始反应向正方向进行,则x的取值范围是
A.1<x<2 B.1<x<5 C.2<x<4 D.2<x<5