下列有关溶液中微粒的物质的量浓度的关系,正确的是
A.0.1 mol·L-1的NH4Cl溶液与0.05 mol·L-1的NaOH溶液等体积混合的溶液:c(Cl-)>c(Na+)>c(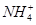 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.等物质的量的NaClO、NaHCO3混合溶液:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(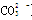 )
)
C.pH=2的HA溶液与pH=12的MOH溶液等体积混合:c(M+)=c(A-)>c(OH-)=c(H+)
D.某二元弱酸的酸式盐NaHA溶液:c(OH-)+c(H2A)=c(H+)+2c(A2-)
海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用以达到富集的目的,化学反应为Br2+SO2+2H2O === 2HBr+H2SO4,下列说法正确的是( )
| A.H2SO4是还原产物 | B.Br2在反应中表现氧化性 |
| C.Br2在反应中失去电子 | D.1 mol氧化剂在反应中得到1 mol电子 |
等质量的铁分别与足量的盐酸、水蒸气在一定的条件下充分反应,则在相同的条件下,产生氢气的体积比是( )
| A.1∶1 | B.3∶4 | C.2∶3 | D.4∶3 |
下列各组数据中,前者刚好是后者两倍的是( )
| A.2 mol水的摩尔质量和1 mol水的摩尔质量 |
| B.200 mL 1 mol/L氯化钙溶液中c(Cl-)和100 mL 2 mol/L氯化钾溶液中c(Cl-) |
| C.20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度 |
| D.64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数 |
下列实验过程中对异常情况的原因分析,没有依据的是( )
| 选项 |
异常情况 |
可能的原因 |
| A |
蒸发结晶时,蒸发皿破裂 |
将溶液蒸干,或酒精灯灯芯碰到蒸发皿底部 |
| B |
分液时,分液漏斗中的液体很难滴下 |
没有打开分液漏斗颈上的玻璃塞或塞上的凹槽与漏斗上小孔没有对齐 |
| C |
萃取时,振荡溶液,静置不分层 |
萃取剂加的太多 |
| D |
蒸馏时,发现冷凝管破裂 |
没有通冷凝水或先加热后通冷凝水 |
常温常压下,乙烷、乙炔和丙烯组成的混合烃64mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了112 mL,原混合烃中乙炔的体积分数为
| A.12.5% | B.25% | C.50% | D.75% |