用氢氧化钠固体配制0.1 mol/L的氢氧化钠溶液,下列说法错误的是
| A.定容时俯视,会造成浓度偏高 |
| B.转移时不慎将转移液溅出,会造成浓度偏低 |
| C.称量时托盘上要垫上干净的称量纸 |
| D.定容摇匀后发现液面下降,不应继续加水 |
用下列实验装置进行的实验中,能达到相应实验目的的是
| A.装置甲:验证Na和水反应放热 |
| B.装置乙:除去乙烯中混有的乙炔 |
| C.装置丙:用于实验室制硝基苯 |
| D.装置丁:说明反应2NO2(g) ⇋ N2O4(g)是放热反应 |
如图是部分短周期元素化合价与原子序数的关系,下列说法正确的是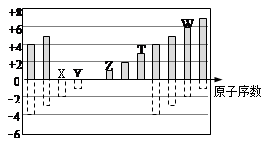
| A.最高价氧化物对应水化物酸性: Y>W>T |
| B.气态氢化物的稳定性:Y>W |
| C.单质氧化性:W>X |
| D.离子半径: W>X>Z>T |
向Na2CO3溶液中逐滴加入水杨酸(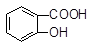 )溶液,可能发生的反应的离子方程式且书写正确的是
)溶液,可能发生的反应的离子方程式且书写正确的是
A.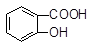 +CO32―→ +CO32―→ +HCO3― +HCO3― |
B.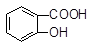 +CO32―→ +CO32―→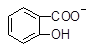 +HCO3― +HCO3― |
C.2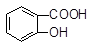 +CO32―→2 +CO32―→2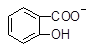 +CO2↑ +CO2↑ |
D.3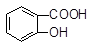 +2CO32―→3 +2CO32―→3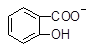 +HCO3―+H2O+CO2↑ +HCO3―+H2O+CO2↑ |
将a g铝粉加入过量NaOH溶液中充分反应后,铝粉完全溶解,并收集到标准状况下b L氢气,所得溶液中共有c个溶质离子,反应中转移电子d个。则阿伏加德罗常数(NA)可表示为
A.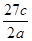 |
B.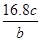 |
C.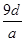 |
D.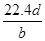 |
含有下列各组离子的溶液中,滴入过量溴水后仍能大量共存的是
| A.Na+、Fe2+、SO42-、Cl― |
| B.Ag+、Al3+、H+、NO3― |
| C.Na+、K+、SO42-、SO32- |
| D.NH4+、Ca2+、NO3―、Cl- |