在1L的密闭容器中通入2molNH3,在一定温度下发生下列反应:2NH3⇌N2+3H2,达到平衡时,容器内N2的百分含量为a%。若维持容器的体积和温度都不变,分别通入下列初始物质,达到平衡时,容器内N2的百分含量也为a%的是
| A.3molH2+1molN2 |
| B.2molNH3+1molN2 |
| C.2molN2+3molH2 |
| D.0.1molNH3+0.95molN2+2.85molH2 |
分类是学习和研究化学的一种常用的科学方法。下列分类合理的是 ()
| A.根据酸分子中含氢原子个数将酸分为一元酸、二元酸等 |
| B.根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应 |
| C.根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质 |
| D.根据元素原子最外层电子数的多少将元素分为金属和非金属 |
(本题共16分)将1.68克铁粉投入100mL稀硝酸中,两物质恰好完全反应,硝酸的还 原产物全部是NO。向反应后的溶液中加入一定量的NaOH溶液,恰好使铁元素完全转化为沉淀,过滤,将滤渣洗涤、干燥、灼烧、称重,得固体a克,把滤液蒸干、灼烧、称重,得固体b克。
原产物全部是NO。向反应后的溶液中加入一定量的NaOH溶液,恰好使铁元素完全转化为沉淀,过滤,将滤渣洗涤、干燥、灼烧、称重,得固体a克,把滤液蒸干、灼烧、称重,得固体b克。
根据题意完成第57~60题:
57.此硝酸的物质的量浓度范围是;
58.a克固体的成份是,质量为克;
b克固体的成份是,质量范围为克。
59.假如反应中放出NO的体积(标况下)为582.4 mL,若向铁与硝酸反应后的溶液中继续加入铁屑,该溶液还能溶解的铁的质量为。
60.已知:25℃时NaOH的溶解度为118克/100克水。25℃时,把15克NaOH固体溶解在一定量水中,配成20克溶液,其密度为1.44g/mL。用该溶液去沉淀铁与硝酸反应后的溶液中的全部铁元素,至少需要取该NaOH溶液mL。
已知:两个羟基同时连在同一碳原子上的结构是不稳定的,它将发生脱水反应:
现有分子式为C9H8O2Br2的物质M,已知有机物C的相对分子质量为60,E的化学式为C7H5O2Na在一定条件下可发生下述一系列反应:
根据题意完成第51~56题:
51.C的结构简式为;M的结构简式为。
52.G→H的反应类型是;H→I的反应类型是;
53 .1 mol M在NaOH溶液中充分反应,最多消耗
.1 mol M在NaOH溶液中充分反应,最多消耗 mol NaOH。
mol NaOH。
54.写出E→ F的化学方程式: ;
;
55.请写出同时符合下列条件的G的同分异构体的结构简式 。(任写一种)
。(任写一种)
a、分子中含有苯环 b、能发生水解反应
c、能发生银镜反应 d、与FeCl3溶液反应显紫色
56.G脱去一个官能团后的物质在一定条件下能够与HCHO反应,生成一种高分子化合物,写出该反应的化学方程式: 。
。
已知:R-CH=CH-O-R′(烃基烯基醚)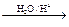 R-CH2CHO + R′OH
R-CH2CHO + R′OH
烃基烯基醚A的相对分子质量(Mr)为176,分子中碳氢原子数目比为3∶4 。与A相关的反应如下:
根据题意完成第47~50题:
47.A的分子式为;
48.B的名称是 ;A的结构简式为
;A的结构简式为 ;
;
49.写出C → D反应的化学方程式:;
50.写出两 种同时符合下列条件的E的同分异构体的结构简式:
种同时符合下列条件的E的同分异构体的结构简式:
① 属于芳香醛;② 苯环上有两种不同环境的氢原子: 、。
、。
MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研 究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下:
究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下:
已知第② 步反应的离子方程式为:5Mn2+ + 2ClO3- + 4H2O → 5MnO2↓ + Cl2↑
步反应的离子方程式为:5Mn2+ + 2ClO3- + 4H2O → 5MnO2↓ + Cl2↑ + 8H+
+ 8H+
根据题意完成第41~46题:
41.第①步加稀H2SO4时,粗MnO2样品中的(写化学式)转化为可溶性 物质。
物质。
42.写出第③步反应的化学方程式 ;
;
43.实验室里完成第③步蒸发操作必需的仪器有铁架台(含铁圈)、、、玻璃棒。
44.该流程中可以循环使用的物质是。
45.若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO2,并收集到0.224 L CO2(标准状况下),则在第①步反应中至少需要mol H2SO4。
46.已知2H2O2(l) → 2H2O(l) +O2(g),反应过程的能量变化如图所示。
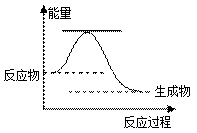 |
①该反应为反应(填“吸热”或“放热”)。
②请用虚线在图中画出使用MnO2作催化剂的情况下反应过程中体系能量变化示意图。