下列说法正确的是
| A.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 |
| B.0.1mol/LNaAlO2溶液中:H+、Na+、Cl-、SO42-能大量共存 |
| C.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-完全沉淀完全: Al3+ +2SO42-+2Ba2++4OH- ===2BaSO4↓+AlO2-+2H2O |
| D.0.10mol/L的氨水与AlCl3溶液发生反应的离子方程式为Al3++3OH-===Al(OH)3↓ |
将0.2 mol·L-1 HCN溶液和0.1 mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系中正确的是
| A.c(HCN) < c(CN—) | B.c(Na+)= c(CN—) |
| C.c(HCN)— c(CN—) = c(OH—) | D.c(HCN)+ c(CN—) =" 0.1" mol·L-1 |
在2A+B 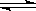 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A.v(A)= 0.5 mol/(L·s)B.v(B)= 0.3 mol/(L·s)
C.v(C)= 0.8 mol/(L·s) D.v(D)= 1 mol/(L·s)
为了避免电解液中CuSO4因水解发生沉淀,正确的操作方法是
| A.稀释 | B.加稀硫酸 | C.加NaOH溶液 | D.加热 |
下列物质的水溶液中,除了水分子外,不存在其他分子的是
| A.HCl | B.NH4NO3 | C.Na2S | D.HClO |
在一定条件下,发生CO(g)+NO2(g) CO2(g)+NO(g)ΔH<0的反应,达到平衡后,保持体积不变,降低温度,混合气体的颜色
CO2(g)+NO(g)ΔH<0的反应,达到平衡后,保持体积不变,降低温度,混合气体的颜色
| A.变深 | B.变浅 | C.不变 | D.无法判断 |