下图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池)。下列有关说法不正确的是
| A.放电时正极反应为:NiOOH+H2O+e-→Ni(OH)2+OH- |
| B.电池的电解液可为KOH溶液 |
| C.充电时负极反应为:MH+OH-→M+H2O+e- |
| D.MH是一类储氢材料,其氢密度越大,电池的能量密度越高 |
下列有机物水解时,键断裂处不正确的是()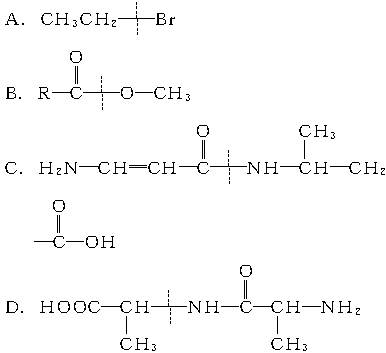
绿色化学是日渐为人们所熟悉的社会概念,绿色食品的基本标准是()
①香甜可口②无污染③表面呈绿色④无化学添加剂⑤有营养价值
| A.①②③⑤ | B.①③④⑤ | C.②④⑤ | D.全部 |
2002年诺贝尔化学奖授予利用“质谱分析法”和“核磁共振技术”等对生物大分子进行研究并作出重大贡献的科学家,下列物质中属于生物大分子的是()
| A.乙醇 | B.葡萄糖 | C.氨基酸 | D.蛋白质 |
2003年发生在广东、北京等部分地区的非典型肺炎,是由病毒感染所引起的,不少群众购买醋精用于室内消毒灭菌,这是因为醋精()
| A.沸点低 | B.能使蛋白质变性 |
| C.具有医疗保健作用 | D.有酸味 |
甲基丙烯酸甲酯是世界上年产量超过100万吨的高分子单体,旧法合成的反应是:(CH3)2C====O+HCN (CH3)2C(OH)CN(CH3)2C(OH)CN+CH3OH+H2SO4
(CH3)2C(OH)CN(CH3)2C(OH)CN+CH3OH+H2SO4 CH2====C(CH3)COOCH3+NH4HSO4
CH2====C(CH3)COOCH3+NH4HSO4
90年代新的反应是:CH3C≡CH+CO+CH3OH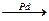 CH2≡C(CH3)COOCH3与旧法比较,新法的优点是( )
CH2≡C(CH3)COOCH3与旧法比较,新法的优点是( )
| A.原料无爆炸危险 |
| B.原料都是无毒物质 |
| C.没有副产物,原料利用率高 |
| D.对设备腐蚀性较小 |