NA为阿伏加德罗常数,下列叙述错误的是
| A.18gH2O中含有的质子数为10NA |
| B.12g金刚石中含有的共价键数为4NA |
| C.46g NO2和N2O4混合气体中含有原子总数为3NA |
| D.1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
将下图所示实验装置的K闭合,下列判断正确的是()
| A.盐桥中的Cl-向乙烧杯方向移动 | B.盐桥中有电子通过 |
| C.乙中的铜棒逐渐变细 | D.片刻后可观察到滤纸a点变红色 |
有A、B、C、D四种金属,将A与B用导线联结起来,浸入电解质溶液中,B不易被腐蚀;将A、D分别投入到等浓度的盐酸中,D比A反应剧烈;将铜浸入B的盐溶液中无明显变化;将铜浸入C的盐溶液中,有金属C析出。据此可推知它们的金属活动性由强到弱的顺序为()
A.D>C>A>B
B.D>A>B>C
C.D>B>A>C
D.B>A>D>C
对下图所示有机物认识不正确的是()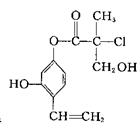
| A.分子式为C12H13O4Cl | B.可以和氢气发生加成反应 |
| C.该有机物属于芳香烃 | D.苯环不是该分子的官能团 |
能正确表示下列化学反应的离子方程式的是()
A.碳酸钙和盐酸反应:CO +2H+ +2H+ H2O+CO2↑ H2O+CO2↑ |
| B.铜片插入硝酸银溶液中:Cu + Ag+ =Cu2+ + Ag |
C.向稀硫酸溶液中加铁:3Fe+6H+ 3Fe3++3H2↑ 3Fe3++3H2↑ |
| D.氧化镁与稀硝酸混合: MgO+2H+=Mg2++H2O |
下列关于氧化物的叙述中,正确的是 ( )
| A.酸性氧化物都能与水化合生成酸 |
| B.碱性氧化物都能与水化合生成碱 |
| C.碱性氧化物一定是金属氧化物,酸性氧化物不一定是非金属氧化物 |
| D.金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物 |