NA为阿伏加德罗常数的数值,下列说法中正确的是
| A.在密闭容器中加入l.5mol H2和0.5molN2,充分反应后可得到NH3分子数为NA |
| B.一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA |
| C.1.0L的0.1 mol·L-1Na2S溶液中含有的S2-离子数为0.1NA |
| D.标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
下列化学用语正确的是
| A.次氯酸的结构式:H-Cl-O | B.C02的球棍模型: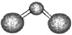 |
C.氯化镁的电子式: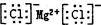 |
D.镁离子结构示意图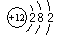 |
下列各组微粒的半径比较中,正确的是
①F<F-<Cl- ②O2-<Mg2+<Al3+ ③P<S<Cl
| A.① | B.③ | C.①③ | D.②③ |
下列叙述,正确的是
| A.离子化合物中一定含有金属元素 | B.离子化合物中只含有离子键 |
| C.离子化合物中一定含有离子键 | D.溶于水可以导电的化合物一定是离子化合物 |
已知原子序数,可能推断原子的
①质子数②中子数③质量数④核电荷数⑤核外电子数
⑥原子结构示意图⑦元素在周期表中的位置
| A.①②③④⑥ | B.①④⑤⑥⑦ | C.②③④⑤⑦ | D.③④⑤⑥⑦ |
下列说法不正确的是
| A.12C和14C互为同位素 | B.乙醇与二甲醚(CH3-O-CH3)互为同分异构体 |
| C.红磷与白磷互为同素异形体 | D.H2O与D2O互为同位素 |