在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3Sn2++2H3AsO3+6H++18Cl-==2As+3SnCl62-+6M。关于该反应的说法中正确的组合是
①氧化剂是H3AsO3
②还原性:Cl->As
③每生成1 mol As,反应中转移电子的物质的量为3 mol
④M为OH-⑤SnCl62-是氧化产物
| A.①②④⑤ | B.①③⑤ |
| C.①②③④ | D.只有①③ |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是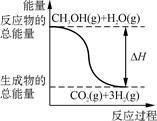
① CH3OH(g)+H2O(g)===CO2(g)+3H2(g);ΔH=+49.0 kJ/mol
② CH3OH(g)+ O2(g)===CO2(g)+2H2(g);ΔH=-192.9 kJ/mol
O2(g)===CO2(g)+2H2(g);ΔH=-192.9 kJ/mol
下列说法正确的是( )
| A.CH3OH的燃烧热为192.9 kJ/mol |
| B.反应①中的能量变化如右图所示 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
D.根据②推知反应:CH3OH(l)+ O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ/mol O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ/mol |
下列有关实验方法和结论都正确的是( )
| A.酸碱中和滴定时,锥形瓶需用待测液润洗2次,再加入待测液 |
| B.联合制碱法是将二氧化碳和氨气通入饱和氯化钠溶液中生成碳酸钠 |
| C.检验蔗糖水解产物具有还原性:在蔗糖水解后的溶液中先加入适量稀NaOH溶液中和,再加入新制的银氨溶液并水浴加热 |
| D.在浓度均为0.01 mol/L NaCl和Na2CrO4的溶液中滴加0.01 mol/L AgNO3溶液,先析出AgCl,则Ksp(AgCl)<Ksp(Ag2CrO4) |
下列操作不能实现实验目的的是( )
| A. 目的:浓度对化学反应速率的影响 |
B. 目的:配制银氨溶液 |
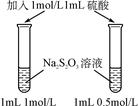 |
 |
| C. 目的:比较Al、Fe、Cu活动性 |
D. 目的:实验室制取氨气 |
 |
 |
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
| A.7.8 g过氧化钠与足量二氧化碳反应转移的电子数为0.1NA |
| B.标准状况下,a L的氧气和氮气的混合物含有的分子数为(a/11.2)NA |
| C.60 g SiO2晶体中含有2NA个Si—O键 |
| D.标准状况下,11.2 L乙醇完全燃烧产生的CO2的分子数为0.5NA |
下列有关物质的性质或应用的说法中正确的是( )
| A.Si是一种非金属主族元素,其氧化物可用于制作计算机芯片 |
| B.石油的催化裂化及裂解可以得到较多的轻质油和气态烯烃 |
| C.Mg、Fe等金属在一定条件下与水反应都生成H2和对应的氢氧化物 |
| D.蛋白质溶液中加入浓的硫酸钠溶液,有沉淀析出,这种作用称为变性 |