某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与100mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成硫单质2.4g,FeCl2 0.425mol和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是
| A.100mL的盐酸中HCl物质的量浓度为7.5mol/L |
| B.生成的H2S气体在标准状况下的体积为2.24L |
| C.该磁黄铁矿中FexS的x=0.85 |
| D.该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3:1 |
某研究性学习小组做铜与浓硫酸反应实验时,发现试管底部有白色固体并夹杂有少量黑色物质。倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有少量水的烧杯中,发现所得溶液为蓝色,黑色固体未溶解。过滤、洗涤后,向黑色固体中加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,所得溶液加BaCl2溶液后有白色沉淀生成。下列所得结论正确的是
| A.铜与浓硫酸反应所得白色固体不是CuSO4 |
| B.加BaCl2溶液后所得白色沉淀是BaSO3 |
| C.白色固体中夹杂的少量黑色物质可能是CuO |
| D.白色固体中夹杂的少量黑色物质中一定含有元素Cu和S |
500 mL KNO3和Cu(NO3)2的混合溶液中c( )=6.0 mol·L-1,用石墨做电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
)=6.0 mol·L-1,用石墨做电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
| A.原混合溶液中c(K+)为2 mol·L-1 |
| B.上述电解过程中共转移6 mol电子 |
| C.电解得到的Cu的物质的量为0.5 mol |
| D.电解后溶液中c(H+)为2 mol·L-1 |
一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收。用下图装置加热硫酸铜粉末直至完全分解。若硫酸铜粉末质量为10.0 g,完全分解后,各装置的质量变化关系如下表所示。
| 装置 |
A(试管+粉末) |
B |
C |
| 反应前 |
42.0 g |
75.0 g |
140.0 g |
| 反应后 |
37.0 g |
79.5 g |
140.0 g |
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是
A.4CuSO4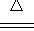 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑
B.3CuSO4 3CuO+SO3↑+2SO2↑+O2↑
3CuO+SO3↑+2SO2↑+O2↑
C.5CuSO4 5CuO+SO3↑+4SO2↑+2O2↑
5CuO+SO3↑+4SO2↑+2O2↑
D.6CuSO4 6CuO+4SO3↑+2SO2↑+O2↑
6CuO+4SO3↑+2SO2↑+O2↑
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是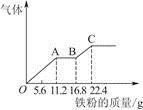
A.原混合酸中 物质的量浓度为2 mol/L 物质的量浓度为2 mol/L |
| B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
| C.第二份溶液中最终溶质为FeSO4 |
| D.H2SO4浓度为2.5 mol/L |
下列推断正确的是
| 事实 |
结论 |
|
| A |
常温下铁、铜均不溶于浓硫酸 |
常温下铁、铜与浓硫酸均不反应 |
| B |
HCl与Na2CO3溶液反应生成CO2 |
可用饱和Na2CO3溶液除去CO2中的少量HCl |
| C |
氧化铜高温下生成红色物质,该物质可与稀硫酸反应 |
氧化铜高温下可分解生成Cu2O |
| D |
稀、浓硝酸分别与铜反应,还原产物分别为NO和NO2 |
稀硝酸氧化性比浓硝酸强 |