研究CO、SO2、NO等大气污染气体的综合处理与利用具有重要意义。
(1)以CO或CO2与H2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:_____________________(用化学反应方程式表示)。
(2)如图所示是用于合成甲醇产品中甲醇含量的检测仪。写出该仪器工作时的电极反应式:
负极________,正极________。
(3)一定条件下,NO2和SO2反应生成SO3(g)和NO两种气体,现将体积比为1:2的NO2和SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。(填序号)
| A.体系压强保持不变 |
| B.混合气体颜色保持不变 |
| C.SO3、NO的体积比保持不变 |
| D.每消耗 1 mol SO2,同时生成1 mol NO |
当测得上述平衡体系中NO2与SO2体积比为1:6时,则该反应平衡常数K值为_______;
(4)工业常用Na2CO3饱和溶液回收NO、NO2气体:
NO+NO2+Na2CO3=2NaNO2+CO2 2NO2+Na2CO3=NaNO3+NaNO2+CO2
若用足量的Na2CO3溶液完全吸收NO、NO2混合气体,每产生标准状况下CO2 2.24L(CO2气体全部逸出)时,吸收液质量就增加4.4g,则混合气体中NO和NO2体积比为_______。
下列离子反应方程式能正确表达相关反应的是
| A.在FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| B.用石墨电极电解氯化镁溶液:2Cl-+2H2O电解Cl2↑+H2↑+2OH- |
| C.向CaCl2溶液中通入CO2气体:Ca2++CO2+H2O=CaCO3↓+2H+ |
| D.等物质的量浓度的小苏打溶液和石灰水按体积比3:2混合: |
3HCO3-+2Ca2++3OH-=2CaCO3↓+CO32-+3H2O
在K2CrO4的溶液中存在着如下的平衡:2CrO42- + 2H+ Cr2O72- + H2O, K=1×1014。若用0.05mol K2Cr2O7配制成1 L K2CrO4溶液,其中c(Cr2O72-)<10-5mol/L,则所配溶液的pH
Cr2O72- + H2O, K=1×1014。若用0.05mol K2Cr2O7配制成1 L K2CrO4溶液,其中c(Cr2O72-)<10-5mol/L,则所配溶液的pH
| A.>7 | B.<7 | C.=7 | D.无法确定 |
下列与有机物的结构、性质有关的叙述正确的是
| A.用新制氢氧化铜悬浊液无法鉴别葡萄糖和乙酸 |
| B.乙酸与乙醇可以发生酯化反应,又均可与碳酸氢钠溶液反应 |
| C.硫酸铵、硫酸铜和乙醇均能使蛋白质变性 |
| D.二氯甲烷不存在同分异构体 |
如下图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中分别加入2 mol X和2 mol Y,开始时容器的体积均为V L,发生如下反应并达到平衡状态(提示:物质X、Y的状态均未知,物质Z的状态为气态):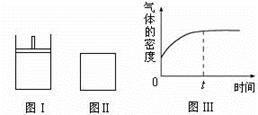
2X(?)+ Y(?) a Z(g)。
a Z(g)。
此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是
| A.物质Z的化学计量数a = 2 |
| B.若X、Y均为气态,则在平衡时X的转化率:Ⅰ> Ⅱ |
| C.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y都为气态 |
| D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ |
甲、乙、丙、丁为中学常见物质,其中甲、乙为单质,丙为氧化物,它们之间存在如图所示的转化关系。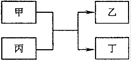 下列说法正确的是
下列说法正确的是
| A.若甲、乙均为金属单质,则丁所属的物质类别一定是碱性氧化物 |
| B.若甲为金属单质,乙为非金属单质,则甲只能是Mg |
| C.若甲、乙元素是同主族元素,根据元素周期表推测,此时乙单质可能是Si |
| D.若甲、乙元素是同周期元素,则该反应的化学方程式一定为:2F2 + 2H2O=4HF + O2 |