液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列关于该燃料电池的叙述不正确的是
| A.电流从右侧电极经过负载后流向左侧电极 |
| B.负极发生的电极反应式为:N2H4 + 4OH- - 4e - = N2+ 4H2O |
| C.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 |
| D.该燃料电池持续放电时,正极发生氧化反应,PH减小 |
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是()
| A.氢氧燃料电池的负极反应式:O2 + 2H2O+ 4e- = 4OH - |
| B.铅蓄电池充电时,标示“+”的接线柱连电源的正极,电极反应式为:PbSO4(S)-2e - + 2H2O(l)=PbO2(S) + 4H+(aq)+ SO42-(aq) |
| C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e- = Cu2+ |
| D.钢铁发生电化学腐蚀的正极反应式:Fe-2e - = Fe2+ |
关于下列过程熵变的判断不正确的是( )
A.溶解少量食盐于水中, |
B.纯碳和氧气反应生成 |
C.H2O(g)变成液态水, |
D.CaCO3(s)加热分解为CaO和CO2(g), |
将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用1 mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示。则下列选项正确的是
| A.原合金质量为0.92 g | B.标准状况下产生氢气896 mL |
| C.图中V2为60 mL | D.图中m值为1.56 g |
某固体物质和某溶液在一定条件下反应,产生气体的相对分子质量(或平均相对分子质量)为45,则发生反应的物质一定不可能是
| A.Zn和浓H2SO4 | B.Na2O2和NH4Cl浓溶液 |
| C.Cu和浓HNO3 | D.C和浓HNO3 |
常温下,下列各组离子在溶液中一定能大量共存的是
| A.1.0mol/L的KNO3溶液:H+、Fe2+、Cl一、SO42一 |
| B.与铝反应产生大量氢气的溶液:Na+、K+、HCO3—、NO3一 |
C.pH=12的溶液: 、 、 、 、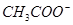 、Br- 、Br- |
D.由水电离产生的 的溶液: 的溶液: 、 、 、 、 、 、 |