一定条件下,使X(g)与Y(g)在2L密闭容器中发生反应生成z(g)。温度为TK时,反应过程中X,Y,Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T, K和T2 K时,Y的体积分数与时间的关系如图2所示。则下列结论正确的是
| A.反应进行的前3 min内,用X表示的反应速率V(X)=0.1 mol/(L·min) |
B.平衡时容器内的压强为反应前的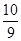 倍 倍 |
| C.保持其他条件不变,升高温度,反应的化学平衡常数K减小 |
| D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是
| A.CuS的溶解度大于PbS的溶解度 |
| B.原生铜的硫化物具有还原性,而铜蓝没有还原性 |
| C.CuSO4与ZnS反应的离子方程式是Cu2++S2-══ CuS↓ |
| D.整个过程涉及的反应类型有氧化还原反应和复分解反应 |
在FeCl2、CuCl2和FeCl3的混合溶液中加入铁粉,充分反应后,滤出的不溶物中除铜粉外,还有少量铁粉,则滤液中
| A.肯定有Fe2+,可能有Fe3+ | B.肯定有Fe3+,一定没有Cu2+ |
| C.肯定有Cu2+,一定没有Fe3+ | D.肯定有Fe2+,一定没有Fe3+和Cu2+ |
将足量的铝粉分别投入等物质的量浓度的NaOH溶液和盐酸中,待反应结束后,两者产生的气体在相同状况下占有相同的体积。下列叙述不正确的是
| A.消耗铝的质量相等 |
| B.NaOH溶液和盐酸的体积相等 |
| C.两反应中转移的电子数相等 |
| D.反应中生成的NaAlO2和AlCl3物质的量相等 |
下列离子方程式书写正确的是
| A.碳酸氢铵溶液与足量氢氧化钠溶液反应 + OH-NH3·H2O |
| B.AlCl3溶液中加入足量的氨水:Al3++ 4NH3•H2O══AlO2-+4NH4++2H2O |
| C.向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全 2Al3++ 3SO42-+ 3Ba2++ 6OH-2Al(OH)3↓+ 3BaSO4↓ |
| D.FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl- |
若在某溶液中加入过量的氨水或过量的NaOH溶液都能生成沉淀,加入适量的铁粉反应后溶液的质量增加,则该溶液中可能含有
| A.Cu2+ | B.Al3+ | C.Mg2+ | D.Fe3+ |