氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
①工业合成氨的热化学方程式是 。
②若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)_______184.4 kJ。
③已知:

1 mol N-H键断裂吸收的能量约等于_______kJ。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
| T / ℃ |
165 |
175 |
185 |
195 |
| K |
111.9 |
74.1 |
50.6 |
34.8 |
①焓变ΔH(填“>”、“<”或“=”) 0
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比) ,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
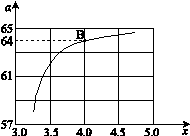
③上图中的B点处,NH3的平衡转化率为_______。
(3)氮气是制备含氮化合物的一种重要物质,而氮的化合物用途广泛。
下面是利用氮气制备含氮化合物的一种途径:
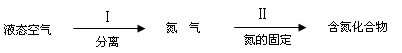
①过程Ⅱ的化学方程式是
②运输时,严禁NH3与卤素(如Cl2)混装运输。若二者接触时剧烈反应产生白烟,并且0.4 mol NH3参加反应时有0.3 mol 电子转移。写出反应的化学方程式
③氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。
已知:4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g) ΔH =" ―1316" kJ/mol,则该燃料电池的负极反应式是 。
( 16分)活性ZnO俗称锌1-3,能改逬玻璃的化学稳定性,可用于生产特种玻璃,在橡胶的虫产屮能缩短硫化吋间,在涂料、油漆等工业也有重要应用。工业上由粗ZnO(含FeO、CuO等.)制备活性ZnO,采取酸浸、净化除杂、中和沉降、干燥煅烧等步骤,工艺流程如下: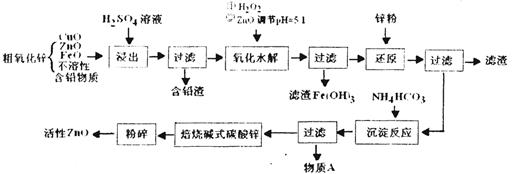
(1 )上述流程屮,浸出用的是60%H2SO4(1.5g/cm3),这种硫酸的物质的量浓度为________(保留两位小数)
(2 )已知ZnO为两性氧化物,与氢氧化钠溶液反应生成可溶性的锌酸盐(Zn02-),写出反应的离子方程式________________
(3) 写出加H2O2吋发生反应的离子方程式________________
(4) 除去Fe(OH)3后,在滤液中加入Zn的目的是________
(5) 上述流程中多次进行了过滤橾作,请写出过滤时用到的玻璃仪器:________________
(6) 物质A是________,检验该溶质阴离子的方法是________
(7) 取碱式碳酸锌6.82g,溶于盐酸生成C02 448mL(标准状况下),溶解过程消耗HCl 0. 12mol,若该碱式盐中氢元素的质量分数为1.76%,试推测该碱式碳酸锌的化学式________
( 14分)水杨酸在医药工业中,是用途极广的消毒防腐剂,可用来软化硬皮或溶解角质的药物,安全性高,且对皮肤的刺激较低,因而成为美容保健品的主角。以下为水杨酸的合成路线,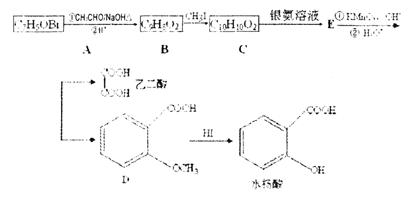
提示: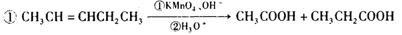
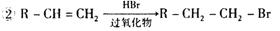
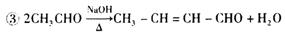
请回答下列问题:
(1) 化合物C中含氧官能团的名称__________。简述检验C中的无氧官能团的操作________________________________________________________________
(2) 化合物D有多种同分异构体,其中一类同分异构体是苯的二取代物,且在酸性条件下水解后生成的产物之一能发生银镜反应。这类同分异构体共有________种。
(3) B—C反应类型________________。
(4) 上述转化过程中,反应步骤 的目的是________________。
的目的是________________。
(5) 从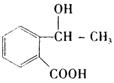 合成
合成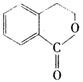 的过程,共有几个步骤.用化学方程式表示其中的第2步和最后一步的反应(注明反应条件)________________________________________
的过程,共有几个步骤.用化学方程式表示其中的第2步和最后一步的反应(注明反应条件)________________________________________
(14分)X、Y、Z、W是元素周期表前四周期中的常见元素,其原子序数依次增大。X元素的一种核素的质量数为12,中子数为6;Y元素是动植物生长不可缺少、构成蛋白质的重要组成元素;Z的基态原子核外9个轨道上填充了电子,且核外有2个未成对电子,与Y不同族;W是一种常见元素,可以形成3种氧化物,其中一种氧化物是具有磁性的黑色晶体。
(1) 常温常压下Z单质是_______晶体(填类型),微粒间通过______形成晶体(填微粒间相互作用的类型)。Y2分子中存在 键和
键和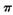 键个数之比为____________。
键个数之比为____________。
(2) X-H和Y—H属于极性共价键,其中极性较强的键是______(X、Y用元素符号表示)。X的第一电离能比Y的______(填“大”或“小“)。
(3) 写出X单质与Z的最高价氧化物对应的水化物的浓溶液反应的化学方程式____________________________________________________________
(4)W的基态原子的外围电子排布式是____________。
(5) 已知一种分子Y4分子结构如上图所示:断裂1molY—Y吸收167KJ的热量,生成1molY Y放出942KJ热量。试写出由Y4气态分子变成Y2气态分子的热化学方程式___
Y放出942KJ热量。试写出由Y4气态分子变成Y2气态分子的热化学方程式___ _____________________
_____________________
t℃时,将3molA和1molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) 
 xC(g)。2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)。2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x=
(2)从反应开始至达到平衡状态,反应物A的转化率为;A的平均反应速率为。
高炉炼铁中发生的基本反应之一如下:
FeO(固)+CO(气) Fe(固)+CO2(气)ΔH>0
Fe(固)+CO2(气)ΔH>0
(1)则该反应中平衡常数K=。
(2)已知1100℃时K=0.263。1100℃时测得高炉中c(CO2)=0.025mol·L-1,c(CO)=0.1mol·L-1在这种情况下,该反应是否处于平衡状态(选填是或否),此时化学反应速率是v正v逆(选填>,<,=)