在容积不变的密闭容器中,在一定条件下发生反应:2A(?)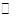 B (g)+C(s),且达到平衡,当升高温度时,容器内气体的密度变大,则下列判断错误的是
B (g)+C(s),且达到平衡,当升高温度时,容器内气体的密度变大,则下列判断错误的是
| A.若正反应为吸热反应,则A为非气态 |
| B.若正反应为放热反应,则A为气态 |
| C.若在平衡体系中加入少量C,则该平衡不移动 |
| D.压强对该平衡的移动无影响 |
下列说法中正确的是
| A.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃的条件下ΔH不相同 |
| B.化学反应中的能量变化都表现为热量变化 |
| C.任何放热反应在常温下都能发生 |
| D.化学反应的反应热可通过反应物的键能之和减去生成物的键能之和求得 |
中学化学教材中有大量数据,下列是某同学对数据利用情况,正确的是
| A.利用焓变的数据或熵变的数据一定都能单独判断反应是否能自发进行 |
| B.利用反应热数据的大小判断不同反应的反应速率的大小 |
| C.利用沸点数据推测将一些液体混合物分离开来的可能性 |
| D.利用溶液的pH与7的大小关系,判断PH=6.8的溶液一定显酸性 |
据报道,有一集团拟将在太空建立巨大的集光装置,把太阳光变成激光用于分解海水制氢,其反应可表示为2H2O 2H2↑+O2↑。有下列几种说法:①水分解反应是放热反应;②氢气是一级能源;③使用氢气作燃料有助于控制温室效应;④若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件。其中叙述正确的是
2H2↑+O2↑。有下列几种说法:①水分解反应是放热反应;②氢气是一级能源;③使用氢气作燃料有助于控制温室效应;④若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件。其中叙述正确的是
| A.①② | B.②③ | C.③④ | D.②③④ |
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只能被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是
| A.混合酸液中NO3-的物质的量为0.4mol |
| B.OA段产生是NO,AB段反应为2Fe3++Fe = 3Fe2+,BC段产生氢气 |
| C.溶液中最终溶质为FeSO4 |
| D.c(H2SO4)为5 mol·L-1 |
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为