随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具体有重要意义。
(1)如图是在101 kPa,298K条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中的能量变化示意图。
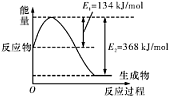
已知:
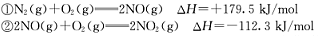
请写出NO与CO反应生成无污染气体的热化学方
程式: 。
(2)将0.20 mol N02和0.10 mol CO充入一个容积恒定为1L的密闭容器中发生反应,在不同条件下,反应过程中部分物质的浓度变化状况如图所示。
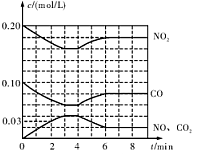
①下列说法正确的是 (填序号)。
a.容器内的压强不发生变化说明该反应达到乎衡
b.当向容器中再充人0. 20 mol NO时,平衡向正反应方向移动,K增大
c.升高温度后,K减小,N02的转化率减小
d.向该容器内充人He气,反应物的体积减小,浓度增大,所以反应速率增大
②计算产物NO在0~2 min内平均反应速率v(NO)= mol·L-1·min-1
③第4 min时改变的反应条件为 (填“升温’’、“降温’’)。
④计算反应在第6 min时的平衡常数K= 。若保持温度不变,此时再向容器中充人CO、NO各0.060 mol,平衡将 移动(填“正向”、“逆向”或“不”)。
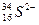 中的质子数是____________,中子数是____________,核外电子数是____________,质量数是____________。
中的质子数是____________,中子数是____________,核外电子数是____________,质量数是____________。
两种气态物质Am和Bn,已知2.4 g Am和2.1 g Bn所含的原子个数相等,而分子个数之比为2∶3,A、B两种元素的原子核中质子数与中子数相等,A原子的L层电子数是K层电子数的3倍。则:
(1)A、B分别是什么元素?
A____________,B____________。
(2)Am中的m值是______________。
今有A、B、C、D四种元素,已知A元素是自然界中含量最多的元素;B元素为金属元素,它的原子核外K、L层电子数之和等于M、N层电子数之和;C元素的单质及其化合物的焰色反应都显黄色;氢气在D元素单质中燃烧呈苍白色。
(1)试推断并写出A、B、C、D四种元素的名称和符号。
(2)写出上述元素两两化合而成的化合物的化学式。
已知X、Y、Z、W四种元素是元素周期表中连续三个不同短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)X、Y、Z、W四种元素的符号:
X.___________;Y.___________;Z.___________;W.___________。
(2)由以上元素中的两种元素组成的共价化合物有___________,离子化合物有___________。(以上任写两种即可)
(3)由X、Y、Z所形成的离子化合物是___________。
周期表前20号元素中,某两种元素的原子序数相差3,周期数相差1,它们形成化合物时原子数之比为1∶2。写出这些化合物的化学式____________。