在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是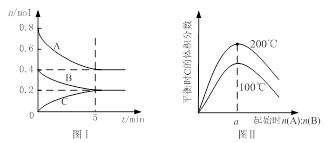
A.200℃时,反应从开始到平衡的平均速率v(B)=" 0." 02 mol·L-1·min-1
B.图Ⅱ所知反应xA(g)+yB(g) zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5
在NO2与水的反应中,水 ( )
| A.是还原剂 | B.是氧化剂 |
| C.既是氧化剂又是还原剂 | D.既不是氧化剂又不是还原剂 |
起固氮作用的化学反应的是: ( )
| A.工业上用氮气和氢气合成氨气 | B.一氧化氮与氧气反应生成二氧化氮 |
| C.氨气经催化氧化生成一氧化氮 | D.由氨气制化肥碳酸氢铵和硫酸铵 |
下列说法错误的是 ( )
| A.原子晶体中只存在非极性共价键 |
| B.分子晶体的状态变化,只需克服分子间相互作用 |
| C.金属晶体通常具有导电、导热和良好的延展性 |
| D.离子晶体在熔化状态下能导电 |
下列说法正确的是 ( )
| A.用乙醇或CCl4可提取碘水中的碘单质 |
| B.NaCl和SiC晶体熔化时,克服粒子间作用力的类型相同 |
| C.24Mg32S晶体中电子总数与中子总数之比为1∶1 |
| D.H2S和SiF4分子中各原子最外层都满足8电子结构 |
根据同分异构体的概念,判断下列物质互为同分异构体的是 ( )
| A.CH3-CH2-CH3和 CH3-CH2-CH2-CH3 | B.NO和CO |
| C.CH3-CH2OH和 CH3-O-CH3 | D.红磷和白磷 |