NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol·L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如右图。据图分析,下列判断不正确的是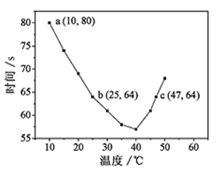
| A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 |
| B.图中b、c两点对应的NaHSO3反应速率相等 |
| C.图中a点对应的NaHSO3反应速率为5.0 ×10-5mol·L-1·s-1 |
| D.温度高于40℃时,淀粉不宜用作该试验的指示剂 |
金属钛对体液无毒且有惰性,能与肌肉和骨骼生长在一起,因而有“生物金属”之称。下列有关2248Ti和2250Ti的说法中正确的是( )
| A.2248Ti和2250Ti原子中均含有22个中子 |
| B.2248Ti和2250Ti核外均有4个电子层 |
| C.分别由2248Ti和2250Ti组成的金属钛单质互称为同分异构体 |
| D.2248Ti与2250Ti为同一核素 |
下列选项中所涉及的两个量一定相等的是
| A.6.2 g Na2O和7.8 g Na2O2中所含的离子数 |
| B.电解精炼铜时阳极溶解与阴极析出的铜的质量 |
| C.11.2 L N2与14 g CO气体所含有的原子数 |
| D.20 g重水(D2O)与17 g NH3所含有的电子数 |
下列溶液中微粒浓度关系一定正确的是
A.氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH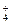 ) ) |
| B.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) |
C.0.1 mol·L 的硫酸铵溶液中:c(NH 的硫酸铵溶液中:c(NH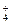 )>c(SO )>c(SO )>c(H+) )>c(H+) |
D.0.1 mol·L 的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+2C(H2S) 的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+2C(H2S) |
下列各组离子一定能大量共存的是
| A.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- |
| B.在强碱溶液中:Na+、K+、AlO2-、CO32- |
| C.在c(H+)=10-13mol/L的溶液中:NH4+、Al3+、SO42-、NO3- |
| D.在PH=1的溶液中:K+、Fe2+、Cl-、NO3- |
使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度偏低的是
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
②用滴定管量取液体时,开始时平视读数,结束时俯视读数
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
| A.①③⑤⑥ | B.①②⑤⑥ | C.②③④⑥ | D.③④⑤⑥ |