已知某温度下CH3COOH和NH3•H2O 的电离常数相等,现向10mL浓度为0.1mol•L‾1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中
| A.水的电离程度始终增大 |
| B.c(NH4+)/c(NH3•H2O)先增大再减小 |
| C.c(CH3COOH)与c(CH3COO‾)之和始终保持不变 |
| D.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO‾) |
室温下,有关下列四种溶液的叙述正确的是(忽略溶液混合的体积变化)
| ① |
② |
③ |
④ |
|
| pH |
12 |
12 |
2 |
2 |
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
A.在①、②中分别加入氯化铵晶体,两溶液的pH值均增大
B.分别将等体积的①和②加水稀释100倍,所得溶液的pH:①>②
C.把①、④两溶液等体积混合后所得溶液显酸性
D.将溶液②和溶液③等体积混合,混合后所得溶液pH=7
已知水在25℃和95℃时,其电离平衡曲线如右图所示,下列说法错误的是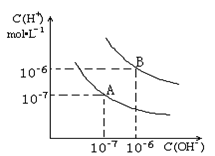
| A.95℃时,pH=4的H2SO4溶液中,由水电离出的c(OH-)=1×10-10mol/L |
| B.15℃时,pH=7的溶液呈酸性 |
| C.AB连线上的点均表示中性溶液 |
| D.B点对应的温度高于A点对应的温度 |
上图是298K 时N2与H2反应过程中能量变化的曲线图。下列叙述错误的是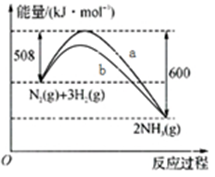
A.该反应的热化学方程式为:N2(g) + 3H2(g)  2NH3(g) ΔH =-92kJ·mol-1 2NH3(g) ΔH =-92kJ·mol-1 |
| B.b曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂, 该化学反应的活化能和反应热都改变 |
| D.在温度体积一定的条件下, 通入lmol N2和3molH2反应后放出的热量为Q1kJ, 若通入2mol N2和6mol H2反应后放出的热量为Q2kJ 则184>Q2 >2Q1 |
上图为某化学反应的速率与时间的关系示意图。在t1 时刻改变温度或压强,正逆反应速率的变化都符合示意图的反应是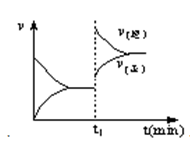
A.2SO2(g)+O2(g)  2SO3(g);ΔH<0 2SO3(g);ΔH<0 |
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g);ΔH<0 4NO(g)+6H2O(g);ΔH<0 |
C.H2(g)+I2(g) 2HI(g); ΔH>0 2HI(g); ΔH>0 |
D.C(s)+H2O(g) CO(g)+H2(g);ΔH>0 CO(g)+H2(g);ΔH>0 |
对室温下100 mL pH=2的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是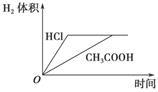
| A.加水稀释至溶液体积为200 mL,醋酸溶液的pH变为4 |
| B.温度都升高20 ℃后,两溶液的pH不再相等 |
| C.加水稀释至溶液体积为200 mL后,醋酸的电离度减小,电离平衡常数也减小 |
| D.加足量的锌充分反应后,两溶液中产生的氢气体积可用上图表示 |