将0.1mol/L的醋酸钠(NaAc)溶液20mL与0.1mol/L盐酸10rnL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是
| A.c(Ac-)>c(Cl-)>c(H+)>c(HAc) |
| B.c(Ac-)>c(HAc)>c(Cl-)>c(H+)>c(OH-) |
| C.c(Ac-)=c(Cl—)>c(H+)>c(HAc) |
| D.c(Na+)+ c(H+)=c(Ac-)+ c(Cl-)+ c(OH-) |
下列反应中不属于酯化反应的是( )
A.CH3CH2OH+HO—NO2 CH3CH2ONO2+H2O
CH3CH2ONO2+H2O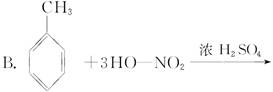
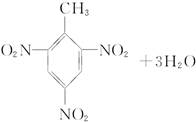
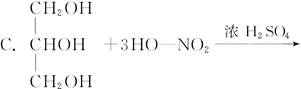
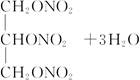
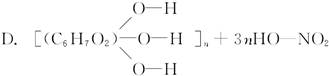
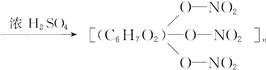 +3nH2O
+3nH2O
下列物质中,不属于酯类的是( )
①酚醛树脂②胶棉③蛋白质④醋酸纤维⑤硬脂酸钠⑥牛油
| A.②④⑥ | B.①③⑤ | C.②④ | D.④⑥ |
为了保护地表的水质,防止河水富营养化,我国对洗衣粉的成分加以限制,其中限制使用的是( )
| A.三聚磷酸钠 |
| B.蛋白酶 |
| C.十二烷基苯磺酸钠 |
| D.硅酸钠 |
下列同组的两物质,不是同分异构体的是( )
| A.乙醇和甲醚 |
| B.苯甲醇和甲基苯酚 |
| C.淀粉和纤维素 |
| D.硝基乙烷和氨基乙酸 |
物质的量相等的戊烷、苯和苯酚完全燃烧需要氧气的物质的量依次是x mol、y mol、z mol,则x、y、z的关系是()
| A.x>y>z | B.y>z>x | C.z>y>x | D.y>x>z |