25℃时,用浓度为0.1000 mol/L的NaOH溶液滴定20.00 mL浓度均为0.1000 mol/L的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是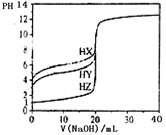
| A.在相同温度下,同浓度的三种酸溶液的导电能力顺序: HZ<HY< HX |
| B.在HZ中加入NaOH至恰好完全反应时,溶液中各离子浓度大小顺序: c(Na+)>c(Z-)>c(OH—)>c(H+) |
| C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X—)+c(Y—)+c(OH—)= c(Na+)+c(H+) |
| D.将HX和HZ溶液混合后,用NaOH溶液滴定至HX恰好完全反应时:c(Na+)= c(X—)+ c(Z—) |
高温下硫酸亚铁发生如下反应:2FeSO4 Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是( )
Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是( )
| A.BaSO3和BaSO4 | B.BaS | C.BaSO3 | D.BaSO4 |
可用如图装置制取(必要时可加热)、净化、收集的气体是()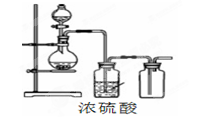
| A.铜和稀硝酸制一氧化氮 | B.氯化钠与浓硫酸制氯化氢 |
| C.锌和稀硫酸制氢气 | D.硫化亚铁与稀硫酸制硫化氢 |
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可使湿润的红色石蕊试纸变蓝,由此可知()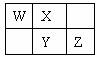
| A.X、Y、Z中最简单氢化物稳定性最弱的是Y |
| B.Z元素氧化物对应水化物的酸性一定强于Y |
| C.X元素形成的单核阴离子还原性强于Y |
| D.Z元素单质在化学反应中只表现氧化性 |
强酸X的转化关系如图: 图中单质可能为()
图中单质可能为()
| A.C | B.Fe | C.Al | D.Cu |
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A的原子最外层电子数是次外层电子数的2倍,元素B的原子最外层电子数是其电子层数的3倍,D与A为同主族元素,元素C与E形成的化合物CE是厨房常用调味品。下列说法正确的是
A.原子半径:C>D>B>A
B.A、D、E最高价氧化物对应水化物酸性增强
C.只含B元素的物质一定是纯净物
D.化合物C2AB3的水溶液显碱性,可用于洗去铜片表面的油污