邻羟基桂皮酸是合成香精的重要原料,下为合成邻羟基桂皮酸的路线之一
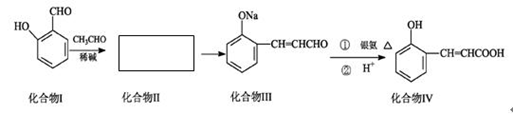
已知: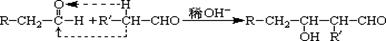
试回答下列问题:
(1)化合物II的结构简式为:
(2)化合物II→化合物III的有机反应类型
(3)化合物III在银氨溶液中发生反应化学方程式
(4)有机物X为化合物IV的同分异构体,且知有机物X有如下特点:①是苯的对位取代物,②能与NaHCO3反应放出气体,③能发生银镜反应。请写出化合物X的结构简式
(5)下列说法正确的是
| A.化合物I遇氯化铁溶液呈紫色 |
| B.化合物II能与NaHCO3溶液反应 |
| C.1mol化合物IV完全燃烧消耗9.5molO2 |
| D.1mol化合物III能与3 mol H2反应 |
(6)有机物R(C9H9ClO3)经过反应也可制得化合物IV,则R在NaOH醇溶液中反应的化学方程式为 。
非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成: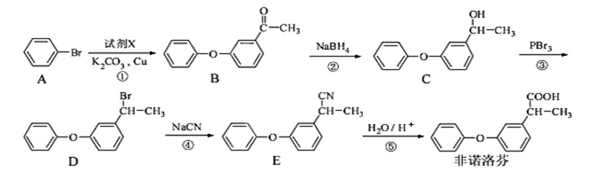
(1)非诺洛芬中的含氧官能团为和(填名称)。
(2)在上述五步反应中,属于取代反应的是(填序号)。
(3)若过程①生成的另一种产物有HBr,写出由A到B发生反应的化学方程式。
(4)非诺洛芬的一种同分异构体满足下列条件:
I.分子中含有两个苯环
II.能与NaHCO3反应放出CO2,能与 FeCl3溶液发生显色反应。
III.分子中有6 种不同化学环境的氢,且各种氢原子个数比为6:2:2:2:1:1。
写出符合条件的一种同分异构体的结构简式:。
(5)下面为以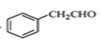 为原料制备
为原料制备 的部分合成路线流程图。
的部分合成路线流程图。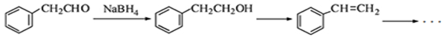
①写出由 的反应方程式;
的反应方程式;
②根据已有知识并结合相关信息把合成路线流程图补充完整(无机试剂任选,在箭头上写出参与反应的物质及反应条件) 。
。
(16分)磷及其化合物在生产、生活中有重要的用途。回答下列问题:
(1)直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵。
①写出磷酸主要的电离方程式:。
②n越大,直链聚磷酸铵的水溶性越(填“大”或“小”)。
(2)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式。
(3)由工业白磷 (含少量砷、铁、镁等) 制备高纯白磷 ( 熔点44℃,沸点280℃),主要生产流程如下:
①除砷过程在75 ℃下进行,其合理的原因是(填字母)。
a.使白磷熔化,提高反应活性
b.降低白磷的毒性
c.温度不宜过高,防止硝酸分解
d.适当提高温度,增大反应速率
②生产过程在高纯氮气保护下进行,其目的是。
③除砷过程中,合成洗涤剂起到作用。
④硝酸氧化除砷时被还原为NO,写出砷转化为砷酸的化学方程式:。
氧化相同质量的砷,当转化为亚砷酸的量越多,消耗硝酸的量越(填“多”或“少”)。
⑤某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如图,砷的脱除率从a点到b点降低的原因是。
(11分)天然气是一种重要的化工原料。
I.2014年5月,我国科学家成功实现了甲烷在无氧条件下选择活化,一步高效生产乙烯、苯、氢气等高值化学品。
(1)苯的二氯代物的同分异构体有种。
(2)乙烯通入溴的四氯化碳溶液中,反应的化学方程式为。
(3)已知甲烷、乙烯、氢气燃烧的热化学方程式分别如下:
①CH4(g) +2O2(g) ="==" CO2(g) +2H2O ( l )ΔH=" -" 890.3 kJ·mol-1
②C2H4(g)+3O2(g) ="==" 2CO2(g) +2H2O ( l )ΔH=" -" 1 306.4 kJ·mol-1
③2H2 (g)+O2 (g) ="==" 2H2O ( l )ΔH=" -" 571.6 kJ·mol-1
则2CH4(g) ===C2H4(g) +2H2 (g) 的ΔH= 。
Ⅱ.甲烷的传统转化利用,第一步制取合成气(CO、H2),第二步用合成气制取甲醇(CH3OH)、二甲醚(CH3OCH3)等。
(4)某温度下,将1mol CH4和1 mol H2O(g)充入容积为0.5 L的密闭容器中,发生如下反应:
CH4(g) +H2O(g) CO(g) +3H2 (g)ΔH=" +206.4" kJ·mol-1
CO(g) +3H2 (g)ΔH=" +206.4" kJ·mol-1
当反应达到平衡时,测得其平衡常数K=27。
①CH4的平衡转化率 = 。
②如果其它条件不变,升高温度,CH4的平衡常数(填“增大”、“减小”或“不变”)。
(5)在一定条件下,合成气发生如下两个主要反应:
CO(g)+2H2(g)="==" CH3OH(g) ΔH= -90.1kJ·mol-1
2CO(g)+4H2(g)="==" CH3OCH3(g) + H2O(g)ΔH= -204.7kJ·mol-1。
仅根据下图,选择该条件下制取甲醇的最佳温度为。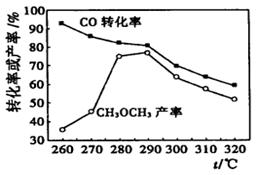
(12分)X、W、Y、Z均为短周期主族元素,原子序数依次增大,Y原子的最外层电子数是X的2倍,X、W、Y在周期表中的相对位置如下图所示。
回答下列问题:
(1)Y元素在元素周期表中的位置是。
(2)列举一个事实证明Y、Z两种元素的非金属性强弱(用化学方程式表示):。
(3)W的最高价氧化物与强碱溶液反应的离子方程式为。
(4)X的最高价氧化物对应水化物 ( H3XO3 ) 是一元弱酸,在横线上填写合适的结构简式:
X (OH)3 + H2O H++
H++
(5)已知25℃:
写出Y的氢化物与钾盐KA溶液(A-表示酸根)反应的化学方程式:。
(6)在烧碱溶液中,以W单质和NiO(OH)(氢氧化氧镍)为两极组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,写出其正极的电极反应式:。
[化学——选修5:有机化学基础]高分子材料PET聚酯树脂和PMMA的合成路线如下:
已知:Ⅰ.RCOOR′+ R′′18OH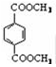 RCO18O R′′+ R′OH(R、R′、R′′代表烃基)
RCO18O R′′+ R′OH(R、R′、R′′代表烃基)
Ⅱ. (R、R′代表烃基)
(R、R′代表烃基)
(1)①的反应类型是________。
(2)②的化学方程式为________。
(3)PMMA单体的官能团名称是________、________。
(4)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为________。
(5)G的结构简式为________。
(6)下列说法正确的是________(填字母序号)。
a.⑦为酯化反应
b.B和D互为同系物
c.D的沸点比同碳原子数的烷烃高
d.1 mol 与足量NaOH溶液反应时,最多消耗4 mol NaOH
(7)J的某种同分异构体与J具有相同官能团,且为顺式结构,其结构简式是________。
(8)写出由PET单体制备PET聚酯(化学式为C10nH8nO4n 或C10n+2H8n+6O4n+2)并生成B的化学方程式 。