用下列实验装置进行相应实验,能达到实验目的的是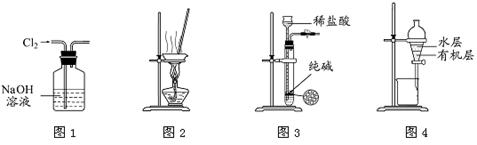
| A.用图1所示装置除去Cl2中含有的少量HCl |
| B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
| C.用图3所示装置制取少量纯净的CO2气体 |
| D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
下列关于药品的使用和作用的说法中,正确的是()
| A.R表示非处方药,OTC表示处方药 |
| B.毒品就是有毒的药品 |
| C.麻黄碱是国际奥委会严格禁止使用的兴奋剂 |
| D.长期大量使用阿司匹林可预防疾病,没有副作用 |
下列家庭垃圾中适合用于堆肥法处理的是
| A.废电池 | B.瓜果壳 | C.旧报纸 | D.塑料瓶 |
现代以石油为基础的三大合成材料是
①合成氨②塑料③医药④合成橡胶⑤合成尿素⑥合成纤维⑦合成洗涤剂
| A.②④⑥ | B.②④⑦ | C.①③⑤ | D.④⑤⑥ |
下列物质是你在生活中经常遇到的物质,其中属于纯净物的
| A.煤 | B.生铁 | C.矿泉水 | D.蒸馏水 |
随着化学工业的发展,各种化学合成材料已经进入我们寻常百姓家庭,下列关于生活中常用材料的认识,准确的是
| A.尼龙、羊毛和棉花都是天然纤维 |
| B.现在生产的各种塑料在自然条件下都不可以降解 |
| C.由酚醛树脂制成的插座破裂后可以热修补 |
| D.装食物的聚乙烯塑料袋可以通过加热进行封口 |