化合物A(C4H10O)是一种有机溶剂。A可以发生以下变化: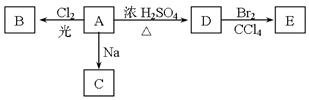
(1)A、D分子中的官能团名称分别是______________、_______________。
(2)A只有一种一氯取代物B。写出由A转化为B的化学方程式:。
(3) A的同分异构体F也可以有框图 内A的各种变化,且F烃基上的一氯取代物有三种。F的结构简式是___________________________________________。
内A的各种变化,且F烃基上的一氯取代物有三种。F的结构简式是___________________________________________。
(4)A与化合物“HQ”在一定条件下相互作用形成水与一种食品抗氧化剂“TBHQ”。已知“HQ”(C6H6O2)可以与三氯化铁溶液发生显色反应,且“HQ”的一硝基取代物只有一种,则“HQ”的结构简式为___________________________。
烃A的分子式为C3H8,B、C是A的一氯代物,A~I有如下转化关系:
回答下列问题:
(1)C的结构简式_____________________。
(2)指出下列反应类型:
A→B:_____________________反应;E→D:______________________反应。
(3)写出下列转化的化学方程式:
B→D:_______________________________________________________________;
E+H→I:_____________________________________________________________。
(4)H有多种同分异构体。写出满足①分子结构中有羟基:②与新制Cu(OH)2共热生成红色沉淀两个条件的一种同分异构体的结构简式:
_________________________________________________________________(只写一种)。
在有机物分子中碳原子所连的4个原子或原子团均不相同时,该碳原子叫手性碳原子,以*C表示。而且,该有机化合物具有光学活性。下列有机物
是否具有光学活性?(填有或无)若有请在上面的结构简式中用*表示出手性碳原子。若消除其光学活性,可选用的化学反应有哪些?请写出化学反应方程式。
1
2
3
4
(本题共6分,每空1分)请同学们根据官能团的不同对下列有机物进行分类。
(1)芳香烃:;(2)卤代烃:;
(3)醇:;(4)酚:;
(5)醛:;(6)酯:。
(本题共5分)你留意过标签上的化学吗?
这是某品牌休闲西服标签上的部分内容:
| 等级:特级 成份:面料羊毛80% 绦纶20% 里料绦纶100% |
 |
| 熨烫标准:中温,不超过150℃ |
回答:(1)其中属于合成纤维的是____________
(2)从此标签中可感觉羊毛、绦纶两种纤维的共同点有________。
(3)将面料、里料中各抽出一根来点燃,可观察到的现象是_______。