相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
X2(g) + 3Y2(g) 2XY3(g) △H="-92.6" kJ.mol-1
2XY3(g) △H="-92.6" kJ.mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 编号 |
起始时各物质物质的量/mol |
达到平衡的时间 |
达平衡时体系能量的变化 |
||
| X2 |
Y2 |
XY3 |
|||
| ① |
1 |
3 |
0 |
2分钟 |
放热46.3kJ |
| ② |
0.4 |
1.2 |
1.2 |
/ |
Q(Q>0) |
下列叙述错误的是
A.平衡时,容器②中X2的体积分数为1/6
B.平衡时,两个容器中XY3的物质的量浓度相等
C.容器①、②中反应的平衡常数相等,K=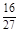
D.容器①体积为0.3L,则达平衡时放出的热量小于46.3kJ
H2S2O3是一种弱酸,实验室欲用0.01mol/L的Na2S2O3溶液滴定I2溶液发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,下列说法合理的是
| A.该滴定可用甲基橙做指示剂 |
| B.Na2S2O3是该反应的还原剂 |
C.该滴定可选用右图所示装置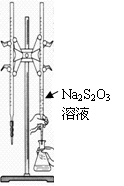 |
| D.该反应中每消耗2mol Na2S2O3,电子转移数为4mol |
短周期元素T、Q、R、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族族序数相等。它们的最高价氧化物水化物依次为甲、乙、丙、丁。下列叙述不正确的是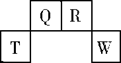
| A.甲、乙、丙、丁受热均易分解 |
| B.常温下丁的浓溶液可用T单质所制的容器来盛装 |
| C.丁的浓溶液与Q的单质加热发生反应,可生成体积比为1:2的两种气体 |
| D.R的氧化物在空气中与其它物质作用可形成光化学烟雾 |
海水开发利用的部分过程如图所示。下列说法错误的是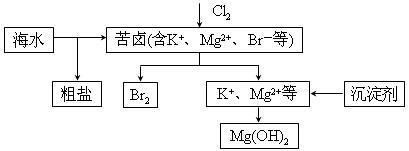
| A.向苦卤中通入Cl2是为了提取溴 |
| B.粗盐可采用除杂和重结晶等过程提纯 |
| C.工业生产中常选用NaOH作为沉淀剂 |
| D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 |
50mL 稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应。下列说法正确的是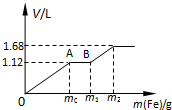
| A.开始时产生的气体为H2 |
| B.AB段发生的反应为置换反应 |
| C.所用混合溶液中c(HNO3)=0.5 mol/L |
| D.参加反应铁粉的总质量m2=5.6g |
水热法制备Fe3O4纳米级颗粒的反应为3Fe2+ +2S2O32-+O2 +xOH-=Fe3O4+S4O62-+2H2O,下列说法中,不正确的是
| A.每生成1mol Fe3O4,反应转移的电子总数为4mol |
| B.Fe2+和S2O32-都是还原剂 |
| C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol |
| D.x=4 |