下列各组热化学方程式中,△H前者大于后者的是
①C(s)+O2(g)=CO2(g); C(s)+1/2O2(g)=CO(g)
②S(s)+O2(g)=SO2(g); S(g)+O2(g)=SO2(g)
③H2(s)+1/2O2(g)=H2O(l); 2H2(g)+O2(g)=2H2O(l)
④2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l); 2KOH(aq)+H2SO4(浓)=K2SO4(aq)+2H2O(l)
| A.①③ | B.②④ | C.①②③ | D.②③④ |
已知C4H10的同分异构体有两种:CH3—CH2—CH2—CH3、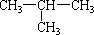 ,则C4H9OH属于醇类的同分异构体共有()
,则C4H9OH属于醇类的同分异构体共有()
| A.l种 | B.2种 | C.3种 | D.4种 |
下列关于乙醇的物理性质的应用中不正确的是()
| A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去 |
| B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分 |
| C.由于乙醇能够以任意比与水互溶,所以酒厂可以勾兑各种浓度的酒 |
| D.从化学学科角度看,俗语“酒香不怕巷子深”中包含乙醇容易挥发的性质 |
下列物质属于醇类的是()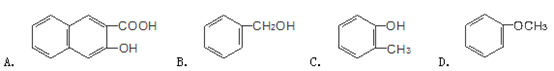
废水中常含有卤代烃。研究发现,把铁粉放在废水中可以除去卤代烃,该过程的机理是Fe+RCH2X+H+→RCH3+X-+Fe2+(X为卤素)。下列说法错误的是()
| A.处理后,废水的pH增大 |
| B.反应过程中RCH2X是氧化剂 |
| C.该反应是置换反应 |
| D.处理含1 mol卤代烃的废水时,转移2 mol电子 |
某种一卤代烃3.925 g跟足量的NaOH溶液混合加热,充分反应后,用HNO3中和过量的烧碱再加适量的AgNO3溶液,生成7.175 g白色沉淀,则该有机物可能是()
| A.溴乙烷 | B.氯乙烷 | C.一氯丙烷 | D.氯仿 |