下列热化学方程式中,正确的是
| A.甲烷的燃烧热ΔH = -890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g),ΔH = -890.3 kJ/mol |
B.一定条件下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) ΔH = -38.6 kJ/mol 2NH3(g) ΔH = -38.6 kJ/mol |
| C.在101 kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) ΔH = -571.6 kJ/mol |
| D.HCl和NaOH反应的中和热ΔH = -57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热ΔH = 2×(-57.3)kJ/mol |
下列离子方程式正确的是
| A.用Fe除去FeCl2溶液中的少量的FeCl3杂质:Fe+Fe3+=2Fe2+ |
B.实验室制取NO2:Cu+4H++2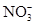 =Cu2++2NO2↑+2H2O =Cu2++2NO2↑+2H2O |
C.硫酸溶液与氢氧化钡溶液混合:H++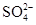 +Ba2++OH-=BaSO4↓+H2O +Ba2++OH-=BaSO4↓+H2O |
D.向氯化铝溶液通足量氨气:Al3++4NH3+4H2O=4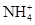 +[Al(OH)4]- +[Al(OH)4]- |
下列叙述正确的是
| A.配制一定物质的量浓度的NaCl溶液,用托盘天平称取NaCl固体5.85 g |
| B.稀释浓硫酸时,将水沿烧杯壁缓慢加入浓硫酸中并不断搅拌 |
| C.滴瓶中的滴管使用时,加完药品后应将滴管洗净后放回原瓶 |
| D.测量醋酸溶液的pH时用蒸馏水润湿pH试纸,测得的pH偏大 |
下列实验操作中正确的是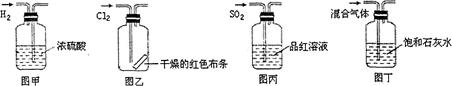
| A.图甲所示,可得到干燥的氢气 |
| B.图乙所示,可以验证氯气的漂白性 |
| C.图丙所示,可以验证SO2的漂白性 |
| D.图丁所示,若石灰水变浑浊,证明混合气体中一定含有CO2 |
下列说法错误的是
| A.浓硫酸具有强氧化性,但SO2气体可以用浓硫酸干燥 |
| B.常温下实验室可以用稀硝酸与铁反应制取NO气体 |
| C.从海水中提取溴的过程中常鼓入热空气,其目的是氧化Br- |
| D.SiO2不仅能与氢氧化钠溶液反应,也能与氢氟酸反应 |
下列各组离子在指定分散系中一定能大量共存的是
A.pH=0的溶液中: 、Fe3+、 、Fe3+、 、Cl- 、Cl- |
B.明矾溶液中:Na+、Mg2+、 、 、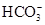 |
| C.氢氧化铁胶体中:H+、K+、Cl-、S2- |
D.使酚酞变红的溶液中:Na+、Ba2+、Cl-、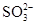 |