已知某气体反应的平衡常数可表示为K=c(X)·c(Y)/[c(Z)]2,该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44。请回答下列问题:
(1)写出上述反应的化学方程式 。
(2)该反应的正反应是 反应(填“放热”或者“吸热”)。
(3)已知在密闭容器中,测得某时刻各组分的浓度如下:
| 物质 |
Z(g) |
X(g) |
Y(g) |
| 浓度/(mol•L﹣1) |
0.54 |
0.68 |
0.68 |
①此时系统温度400℃,比较正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”)。
②若以Z百分含量为纵坐标,以温度为横坐标,
此时反应点在图象的位置是图中 点。比较图中B、D两点所对应的正反应速率B D(填“>”、“<”或“=”),理由是 。
(4)一定条件下要提高反应物的转化率,可以采用的措施是 。
a.升高温度
b.加入催化剂
c.压缩容器的体积
d.增加Z的浓度
e.及时分离出产物
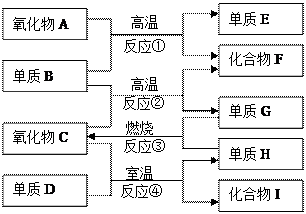
如上图,已知:
①单质E可作为半导体材料;
②化合物F是不能生成盐的氧化物;
③化合物I能溶于水呈酸性,它能够跟氧化物A起反应。
据此,请填空:
(1)化合物F是。
(2)化合物I是。
(3)反应③的化学方程式。
(4)反应④的化学方程式。
某学生试图用电解法根据电极上析出物质的质量来验证阿佛加德罗常数值,其实验方案的要点为:
①用直流电电解氯化铜溶液,所用仪器如图:
②在电流强度为I安培,通电时间为ts钟后,精确测得某电极上析出的铜的质量为mg。
试回答:
(1)连接这些仪器的正确顺序为(用图中标注仪器接线柱的英文字母表示。下同)E接,C接,接F。
实验线路中的电流方向为→ →→C→ →。
(2)写出B电极上发生反应的离子方程式 ,G试管中淀粉KI溶液变化的现象为,相应的离子方程式是。
(3)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序应是。(选填下列操作步骤的编号)
①称量电解前电极的质量
②刮下电解后电极上的铜并清洗
③用蒸馏水清洗电解后电极
④低温烘干电极后称量
⑤低温烘干刮下的铜后称量
⑥再次烘干后称量至恒重
(4)已知电子的电量为1.6×10-19C。试列出阿佛加德罗常数的计算表达式:NA。
将质量相等的铜片和铂片插入硫酸铜溶液中,铜片与电源正极相连,铂片与电源负极相连,以电流强度1A通电10min,然后将电源反接,以电流`强度为2A继续通电10min。试回答:
(1)铜电极和铂电极质量为横坐标,时间为纵坐标,分别作出铜电极、铂电极的质量和时间的关系图。
(2)上述过程中发生的现象是:铜电极;
铂电极。
(3)最后时刻两电极的电极反应式:
铜电极;
铂电极。
已知:HCN的结构为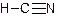 ,R—CN RCOOH,R—Cl+CN- R—CN+Cl-(R为烃基)。玉米芯、甘蔗渣等废物水解发酵后可制得糠醛
,R—CN RCOOH,R—Cl+CN- R—CN+Cl-(R为烃基)。玉米芯、甘蔗渣等废物水解发酵后可制得糠醛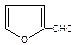 ,它是重要的化工原料,它在一定条件下可发生以下变化:
,它是重要的化工原料,它在一定条件下可发生以下变化:
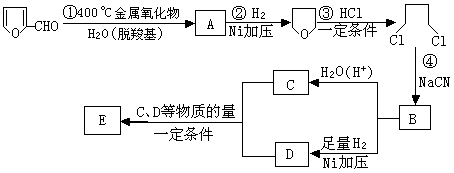
试回答下列问题:
(1)写出A、B、D的结构简式:A,B, D。
(2)写出下列化学方程式:③;
④。
(3)若E为环状化合物,则其结构简式。
(4)若E为高聚物,则其结构简式。
阅读下文,并回答(1)~(3)小题。
20世纪90年代初,国际上提出了“预防污染”这一新概念。绿色化学是“预防污染”的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各五一节都实现净化和无污染的反应途径。
(1)下列各项属于“绿色化学”的是
A.处理废弃物 B.治理污染点
C.减少有毒物 D.杜绝污染源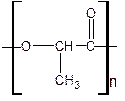 (2)在国际环境问题中,一次性使用聚苯乙烯材料带来的“白色污染”极为严重。最近研制出一种新材料聚乳酸:
(2)在国际环境问题中,一次性使用聚苯乙烯材料带来的“白色污染”极为严重。最近研制出一种新材料聚乳酸:
它能代替聚苯乙烯,它由乳酸聚合而成,能在乳酸菌的作用下,降解而消除对环境的污染。下列关于聚乳酸的说法正确的是
A.聚乳酸的单体是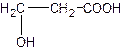
B.聚乳酸的单体自身分子间在一定条件下能够相互反应生成环状化合物
C.聚乳酸是一种羧酸
D.单体聚合成聚乳酸的方式与单体聚合成聚苯乙烯的方式相同
(3)1996年美国罗姆斯公司的G.L.Willingham等人研制出对环境安全的船舶防垢剂──“海洋9号”而获得了美国“总统绿色化学挑战奖”。“海洋9号”的结构简式如下式:
试回答下列问题: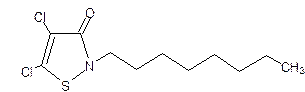
①“海洋9号”的化学式为________;
②“海洋9号”能在一定条件下与H2发生加成反应,写出“海洋9号”与足量氢气加成产物的结构简式;
③若“海洋9号”分子中的氢原子被一个氯原子取代,所得一氯取代物的种数为。