对于常温下pH为2的盐酸,叙述正确的是
| A.溶液中c(Cl-)=c(H+) |
| B.与等体积pH=12的氨水混合后所得溶液显酸性 |
| C.由HCl电离出的H+约为由H2O电离出H+浓度的1010倍 |
| D.与等体积0.01 mol·L-1碳酸钠溶液混合后所得溶液中:c(Na+)═c(CO32-)+ c(HCO3-)+c(H2CO3) |
下列微粒的电子式书写正确的是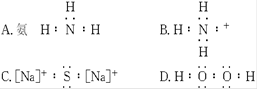
下列性质中,可以证明某化合物内一定存在离子键的是
| A.可溶于水 | B.具有较高的熔点 |
| C.水溶液能导电 | D.熔融状态能导电 |
AB、CD、EF均为1∶1型离子化合物,根据下列数据判断它们的熔点由高至低的顺序是
| AB |
CD |
EF |
|
| 离子电荷数 |
1 |
1 |
2 |
| 键长(10-10 m) |
2.31 |
3.18 |
2.10 |
A.CD>AB>EFB. AB>EF>CD
C.AB>CD>EF D.EF>AB>CD
与Ne的核外电子排布相同的离子跟与Ar的核外电子排布相同的离子所形成的离子化合物是
| A.MgBr2 | B.Na2S | C.KCl | D.SO2 |
某物质的晶体中,含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子不能画出),
晶体中A、B、C的原子个数比依次为
A.1:3:1 B.2:3:1
C.2:2:1 D.1:3:3