[化学——选修2:化学与技术](15分)草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如图所示: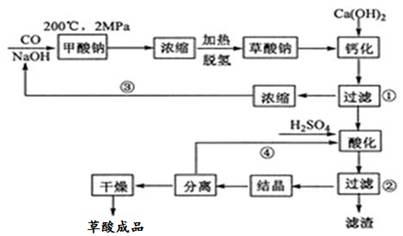
回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为_____、_______。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是__________,滤渣是__________;过滤操作②的滤液是__________和__________,滤渣是__________。
(3)工艺过程中③和④的目的是 。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是__________。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。称量草酸成品0.250 g溶于水,用0.0500mol·L-1的酸性KMnO4溶液滴定,至浅粉红色不消褪,消耗KMnO4溶液15.00 mL,反应的离子方程式为 ;列式计算该成品的纯度____________。
2015年8月12日晚11时20分左右,天津港国际物流中心区域内瑞海公司所属危险品仓库发生的爆炸,造成了严重的人员伤亡,据瑞海国际官网信息,该公司仓储含有以下种类物质:压缩气体天然气、易燃液体乙酸乙酯、遇湿易燃物品电石、氰化钠、腐蚀品硫化碱等。
(1)由于CaC2、金属钠、金属钾等物质能够跟水反应给灾后救援工作带来了很多困难。如果在实验室,你处理金属钠着火的方法是 。(填序号)
A.泡沫灭火器 B.消防车喷水 C.沙土
(2)硫化碱其实就是我们常见的硫化钠,触及皮肤和毛发时会造成灼伤。①其水溶液呈强碱性,故俗称硫化碱。 ②其水溶液在空气中会缓慢地氧化成Na2S2O3,该反应中还原剂与氧化剂物质的量之比为 。
(3)事故发生后,爆炸中心区、爆炸区居民楼周边以及海河等处都受到了严重的氰化物污染。处理NaCN的方法有多种,方法一:用NaClO在碱性条件下跟NaCN反应生成无毒害的物质,试写出该反应的离子反应方程式 。
方法二:这些泄露的氰化钠将通过喷洒双氧水的方式来处理,用双氧水处理后会释放氨气同时生成无毒的碳酸氢钠,以减轻污染。则CN- 被氧化生成的产物为 。
(4)环保部门为测定H202溶液浓度,方法如下:用移液管吸取10. 00mL的H2O2样品盛入l00ml容量瓶中,加水稀释至刻度线,取25.OOmL溶液盛入锥形瓶里,再加入lOmL 3mol/L稀硫酸(过量),用0.02mol/L的标准浓度的KMnO4溶液滴定,所用体积为20.00ml,试写出与H2O2 相等电子数的三原子分子的化学式 。原H2O2溶液的浓度为 mol/L。
[物质结构与性质]下列反应曾用于检测司机是否酒后驾驶:
2Cr2O72-+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH
(1)Cr3+基态核外电子排布式为_______ __;配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是________(填元素符号)。
(2)CH3COOH中C原子轨道杂化类型为___________;1molCH3COOH分子中含有δ键的数目为 _____ _。
(3)与H2O互为等电子体的一种阳离子为_____ ___(填化学式);H2O与CH3CH3OH可以任意比例互溶,除因为它们都是极性分子外,还因为_____ ___。
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是 。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+)=1.0×10-3mol·L-1, c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
②完成NaClO3氧化FeCl2的离子方程式: ClO3-+
ClO3-+ Fe2++
Fe2++ =
= Cl-+
Cl-+ Fe3++
Fe3++ .
.
(3)FeCl3在溶液中分三步水解:
Fe3++H2O  Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:
xFe3++yH2O Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是 。
(4)天津某污水处理厂用氯化铁净化污水的结果如下图所示。由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为 mg·L-1。
(12分)研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为 。利用反应6NO2+ 8NH3 7N5+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N5+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH="-196.6" kJ·mol-1
2SO3(g) ΔH="-196.6" kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH="-113.0" kJ·mol-1
2NO2(g) ΔH="-113.0" kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。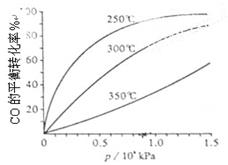
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,用ClO2替代Cl2对自来水进行消毒是城市饮用水处理新技术。工业上制备ClO2的方法很多,可以用合适的还原剂还原NaClO3制得。
(1)在硫酸酸化的条件下用 草酸还原NaClO3制ClO2,其反应的化学方程式为 。
(2)工业以CH3OH与NaClO3为原料在酸性条件下制取ClO2,同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO3-+2Cl-+4H+=2ClO2↑+Cl2↑+2H2O。
①写出第二步反应的离子方程式 。
②工业生产时需在反应物中加少量Cl-,其作用是 。
(3)ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐,写出ClO2与NaOH溶液反应的离子方程式 。
(4)ClO2可用于含CN-废水的处理,产生的两种气体可以直接排入空气。
①已知CN-中C、N的最外层都满足8电子结构,写出CN-的电子式 。
②写出该反应的离子方程式 。