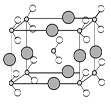[化学——选修3:物质结构与性质](15分)硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为______,该能层具有的原子轨道数为_____、电子数为____。
(2)硅主要以硅酸盐、______等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以______相结合,其晶胞中共有8个原子,其中在面心位置贡献______个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为______________________。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 |
C—C |
C—H |
C一O |
Si—Si |
Si—H |
Si一O |
| 键能/(kJ·mol-1) |
356 |
413 |
336 |
226 |
318 |
452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是_____________。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是__________________________。
(6)在硅酸盐中,SiO44-四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为__________。Si与O的原子数之比为__________________。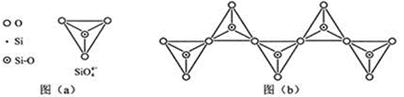
【化学——选修5:有机化学基础】氯贝特是临床上一种降脂抗血栓药物,其结构如下图所示: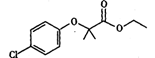
它的一条合成路线如下:
提示:(图中部分反应条件及部分反应物、生成物已略去)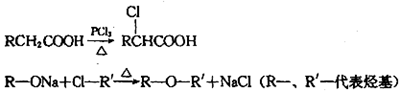
(1)氯贝特的分子式为__________________,其中能发生水解反应的官能团名称为_________。
(2)A→B的反应类型是_________,B的结构简式是____________。
(3)要实现反应①所示的转化,加入下列物质不能达到目的的是 。
a.NaOHb.NaClc.NaHCO3d.Na
(4)D生成氯贝特的化学方程式为___________________________________。
(5)有机物甲有多种同分异构体,请判断同时满足以下条件的所有同分异构体X有______种。
①苯环上有2个取代基;
②属于酯类;
③既能与FeCl3溶液显紫色,又能发生银镜反应。
[化学---选修3:物质结构与性质](15分)太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)铟与镓同是IIIA族元素,写出铟基态原子的电子排布式: 。
(2)硒为第四周期VIA族元素,与其相邻的元素有砷(33号)、溴(35号),则三种元素的电负性由小到大的顺序为 。(用元素符号表示)
(3)SeO3分子的立体构型为 。
(4)硅烷(SinH2n+2)的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是 。
(5)硼元素具有缺电子性,其化合物往往具有加合性,如硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-,其中B原子的杂化类型为 。
(6)金属铜投入氨水中或投入H2O2溶液中均无明显现象,但投入氨水—过氧化氢混合液中,则铜片溶解,溶液呈深蓝色,写出该反应的离子方程式: 。
(7)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为 ;若该晶体的晶胞参数为a pm,则该合金密度为 g/cm3。(列出计算式,不要求计算结果,阿伏伽德罗数的值为NA)
[化学——选修2化学与技术]
(1)我国某地区已探明蕴藏有丰富的赤铁矿(主要成分为Fe2O3,还含有SiO2等杂质)、煤矿、石灰石和黏土。拟在该地区建设大型炼铁厂。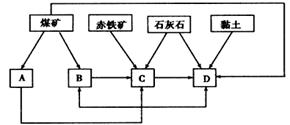
①随着铁矿的开发和炼铁厂的建立,需要在该地区相应建立焦化厂、发电厂、水泥厂等,形成规模的工业体系。据此确定图中相应工厂的名称:
| A.________, | B.________, | C.________, | D.________; |
②以赤铁矿为原料,写出高炉炼铁中得到生铁和产生炉渣的化学方程式:______________。
(2)玻璃钢可由酚醛树脂和玻璃纤维制成。
①酚醛树脂由酚醛和甲醛缩聚而成,反应有大量热放出,为防止温度过高,应向有苯酚的反应釜________地加入甲醛,且反应釜应装有________装置。
②玻璃钢中玻璃纤维的作用是______。玻璃钢具有 等优异性能(写出两点即可)。
③下列处理废旧热固性酚醛塑料的做法合理的是________。
a.深埋b.粉碎后用作树脂填料
c.用作燃料 d.用有机溶剂将其溶解,回收树脂
(3)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上r[n(O2)/n(NH3)]=_____,实际生产要将r值维持在1.7~2.2之间,原因是__________________________。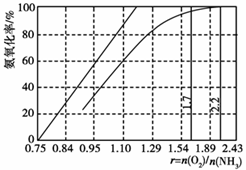
运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H2
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H= 。(请用含有△H1、△H2的式子表示)
(2)NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:2NO(g)+ 2CO(g) 2CO2(g)+ N2(g) △H=—a kJ•mol-1(a>0)。在一定温度下,将2.0mol NO、2.4mol CO气体通入到固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示:
2CO2(g)+ N2(g) △H=—a kJ•mol-1(a>0)。在一定温度下,将2.0mol NO、2.4mol CO气体通入到固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示: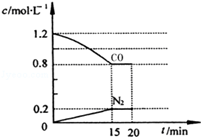
①0~15min N2的平均速率v(N2)= 。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是 (选填序号)。
a.缩小容器体积b.增加CO的量
c.降低温度d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将 移动(选填“向左”、“向右”或“不”)。
(3)某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图所示,利用以下反应:
NO+CO N2+CO2(有CO) 2NO
N2+CO2(有CO) 2NO N2+O2(无CO)
N2+O2(无CO)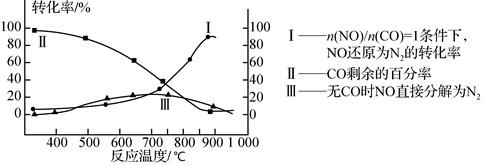
①若不使用CO,温度超过775 ℃,发现NO的分解率降低,其可能的原因为 ;在n(NO)/n(CO)=1的条件下,应控制最佳温度在 左右。
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染。写出C2H6与NO2发生反应的化学方程式 。
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.[物质结构与性质]原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与未成对电子数相等;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为24。
(1)F+基态的核外电子排布式为 。
(2)BA3-的空间构型为 ;1molAD2中含有π键的数目为 。
(3)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 。
(4)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 。
(5)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。