用质量均为100 g的Cu作电极,电解AgNO3溶液。稍电解一段时间后,两电极的质量相差28 g,此时两电极的质量分别为
| A.阳极100 g,阴极128 g | B.阳极93.6 g,阴极121.6 g |
| C.阳极91.0 g,阴极119.0 g | D.阳极86.0 g,阴极114.0 g |
武兹反应是重要的有机增碳反应,可简单地表示为:2R—X + 2Na →R—R + 2NaX,现用CH3CH2Br和C3H7Br和Na一起反应不可能得到的产物是
| A.CH3CH2CH2CH3 | B.(CH3)2CHCH(CH3)2 |
| C.CH3CH2CH2CH2CH3 | D.(CH3CH2)2CHCH3 |
1840年,俄国化学家盖斯(G·H·Hess)从大量的实验事实中总结出了一条规律:化学反应不管是一步完成还是分几步完成,其反应热是相同的,即盖斯定律。盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知每摩单质碳完全燃烧生成CO2放出热量为Y kJ,则1mol C与O2反应生成CO的反应热△H为
| A.-Y kJ/mol | B.-(10X-Y) kJ/mol |
| C.-(5X-0.5Y) kJ/mol | D.+(10X-Y) kJ/mol |
如图所示,夹子开始处于关闭状态,将液体A滴人试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。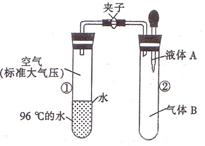
则液体A和气体B的组合不可能是下列的
A.氢氧化 钠溶液.二氧化碳 钠溶液.二氧化碳 |
B.水.氨气 |
| C.氢氧化钠溶液.一氧化氮 | D.水.二氧化氮 |
常温下,测得某无色溶液中由水电离出的C(H+)=1×10-13mol·L-1,则该溶液中一定能共存的离子组是
A.AlO 、NO 、NO 、Na+、Cl- 、Na+、Cl- |
B.Mg2+、SO 、Na+、CIO- 、Na+、CIO- |
C.Fe3+、NO3-、K+、SO |
D.Ba2+、K+、NO 、Cl- 、Cl- |
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O +O2+xOH—
+O2+xOH— =Fe3O4+S4O +2H2O,下列说法中,正确的是:
+2H2O,下列说法中,正确的是:
| A.每生成1mol Fe3O4,反应转移的电子总数为3mol | B.Fe2+和S2O 都是还原剂 都是还原剂 |
| C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol | D.x=2 |