将反应5IO3-+I-+6H+ 3I2+3H2O设计成如下图所示的原电池。开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转。
3I2+3H2O设计成如下图所示的原电池。开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转。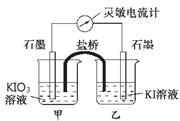
下列判断不正确的是
| A.开始加入少量浓硫酸时,乙中石墨电极上发生氧化反应 |
| B.开始加入少量浓硫酸时,同时在甲、乙烧杯中都加入淀粉溶液,只有乙烧杯中溶液变蓝。 |
| C.电流计读数为零时,反应达到化学平衡状态 |
| D.两次电流计指针偏转方向相反 |
下列有关叙述正确的是()
| A.金属氧化物一定是碱性氧化物 | B.非金属氧化物一定是酸性氧化物 |
| C.碱性氧化物一定是金属氧化物 | D.酸性氧化物一定是非金属氧化物 |
下列各组粒子中,氧化性由强到弱、粒子半径由小到大的一组是()
| A.H+、Al3+、Mg2+、K+ |
| B.Na+、Mg2+、K+、Ca2+ |
| C.O、N、P、S |
| D.I、Br、Cl、F |
已知Be的原子序数为4,下列对Be及其化合物的叙述正确的是()
| A.铍的原子半径小于硼的原子半径 |
| B.单质铍放入水中,水溶液可使酚酞显红色 |
| C.氢氧化铍的碱性比氢氧化钙的弱 |
| D.单质铍跟冷水反应产生氢气 |
短周期元素X和Y,可组成化合物XY3,当X的原子序数为m,Y的原子序数可能是()
①m+4②m-4③m-8④m+2⑤m-6⑥m+12
| A.①②③ | B.①④⑤⑥ | C.①②③④⑤ | D.①②③④⑤⑥ |
已知SO3、BF3、CCl4、PCl5、SF6都是非极性分子,而H2S、NH3、NO2、SF4、BrF5都是极性分子,由此可推出ABn型分子属于非极性分子的经验规律是()
A.ABn型分子中A、B均不含氢原子
B.A元素的相对原子质量必小于B元素的相对原子质量
C.分子中所有原子都在同一平面上
D.分子中A原子最外层电子都已成键