X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。请回答下列问题:
(1)上述元素的最高价氧化物对应的水化物酸性最强的是_______(写化学式),非金属气态氢化物还原性最强的是____________(写化学式)。
(2)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有______(写出其中两种物质的化学式)。
(3)X2M的燃烧热ΔH= -a kJ·mol-1,写出X2M燃烧反应的热化学方程式:______ 。
(4)ZX的电子式为________;ZX与水反应放出气体的化学方程式为_ __。
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作冷剂已成为一种趋势,这一做法对环境的积极意义在于。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如: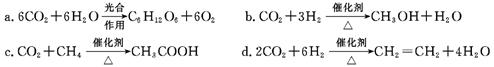
以上反应中,原子利用率最高的是。
(3)若有4.4g CO2与足量H2恰好完全反应,生成液态甲醇和气态水,可放出4.9 kJ的热量,试写出该反应的热化学方程式_______________________________________。
(4)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器,充人1mol CO2和3molH2,进行反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
从反应开始到平衡v(H2)= _____________;该温度下的平衡常数数值=__________。
(5)CO2在自然界循环时可与CaCO3反应。CaCO3是一种难溶物质,其Ksp="=" 2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将4×10-4mol/L Na2CO3溶液与某浓度的CaCl2溶液等体积混合,则生成沉淀所需CaCl2溶液的最小浓度为______________。
已知有机物中一个碳原子上连有两个羟基时,易脱水形成碳氧双键;物质A→F有如下转化关系:
请回答下列问题:
(1)E中含有的官能团的名称是_____________,C跟新制的氢氧化铜悬浊液反应的化学方程式为:________________________________________________________。
(2)已知B的相对分子质量为162,其燃烧产物中n(CO2):n(H2O)=2:1。则B的分子式为_________________。
(3)F具有如下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应。
若F的苯环上的一氯代物只有两种,则F在一定条件下发生加聚反应的化学方程式为:
____________________________________________________________________________。
(4)化合物G是F的同分异构体,它属于芳香族化合物,能发生银镜反应。则G可能具有______________种结构,写出其中两种的结构简式___________、____________。
(1)用0.1mol/L NaOH溶液分别中和pH和体积均相同的盐酸和醋酸,消耗NaOH溶液的体积较多的是。
(2)已知NaHCO3水溶液呈碱性,则其溶液中五种离子的浓度由大到小的顺序是(用规范的浓度符号回答)。
用规范的化学语言回答下列问题:
(1)过氧化钠跟CO2反应的化学方程式。
(2)一定条件下,乙醛可跟氢气反应生成乙醇,该反应的反应类型是。
(3)氯化铵溶液呈酸性的原因(用离子方程式回答)。
(4)氢氧化镁浊液中的溶解沉淀平衡方程式。
(5)氯碱工业中用电解饱和食盐水的方法制取烧碱和氯气,该电解过程中的电极反应方程式为:阳极,阴极。
稀盐酸与铝发生反应,要生成3.36L氢气(标准状况),需消耗铝g;反应过程中转移mol电子。