水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32-+O2+aOH-====Y+S4O62- +2H2O下列说法中,不正确的是
| A.S2O32-是还原剂 |
| B.Y的化学式为Fe2O3 |
| C.a =4 |
| D.每有1molO2参加反应,转移的电子总数为4mol |
下表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断下列叙述正确的是
| 元素代号 |
A |
B |
C |
D |
E |
F |
G |
| 原子半径/nm |
0.152 |
0.160 |
0.089 |
0.143 |
0.102 |
0.099 |
0.071 |
| 主要化合价 |
+1 |
+2 |
+2 |
+3 |
+6、-2 |
-1 |
-1 |
A.单质A在O2中加热,生成A2O2
B.气态氢化物的稳定性HG>HF>H2E
C.B2+、D3+、E2-、G-四种离子的核外电子排布相同
D.单质的活泼性顺序为:A>C>B>D
下列实验过程中的现象及结论均正确且存在因果关系的是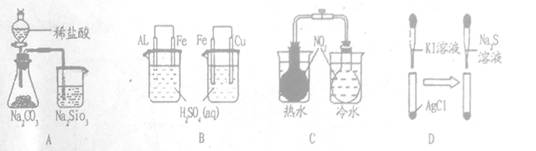
| 实验 |
实验现象 |
结论 |
| A |
锥形瓶中有气体产生,烧杯中液体变混浊 |
非金属性:Cl>S>Si |
| B |
左烧杯铝表面冒气泡,右烧杯铜表面冒气泡 |
活动性:Al>Fe>Cu |
| C |
左烧杯气体颜色加深,右烧杯气体颜色变浅 |
NO2转化为N2O4吸热 |
| D |
白色固体先变为黄色,后变为黑色 |
溶解度:AgCl>AgI>Ag2S |
关于溶液的下列说法正确的是
| A.c(H+):c(OH-)=1:10-2的溶液中K+、Ba2+、ClO-、CO32-一定能大量存在 |
| B.水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量存在 |
C.往0.1mol/LCH3COOH溶液中通人少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中 增大 增大 |
| D.等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3中c(CO32-)的大小关系为:②>④>③>① |
已知NH4++AlO2-+2H2O=Al(OH)3↓+NH3·H2O。向含有等物质的量的NH4Cl、AlCl3和HCl混合溶液中慢慢滴加NaOH溶液至过量,并不断搅拌,可能发生以下离子反应:①H++OH-=H2O;②Al(OH)3+OH-=AlO2-+2H2O;③Al3++3OH-=Al(OH)3↓;④NH4++OH-=NH3·H2O;⑤NH4++AlO2-+2H2O=Al(OH)3↓+NH3·H2O。其正确的离子反应顺序是
| A.①③②④ | B.①③②⑤ | C.①③④② | D.①④③② |
用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.0.1 mol Fe在0.1mol CL2中充分燃烧,转移的电子数为0.3NA |
| B.标准状况下,11.2 L CCl4所含分子数约为0.5NA |
| C.常温下,pH=13的NaOH溶液中,OH-的数目为0.1NA |
| D.常温、常压下,14g CO与N2的混合气含的原子数为NA |