(14分)人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(1)蓄电池在放电时起原电池作用,在充电时起电解池的作用。铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。正极电极反应式为 。
(2)FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu=2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为_________,当线路中转移0.2mol电子时,则被腐蚀铜的质量为 g
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为___________。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片
(4)已知甲醇燃料电池的工作原理如图所示。
该电池工作时,b口通入的物质为___________,该电池正极的电极反应式为:___________,工作一段时间后,当6.4 g甲醇(CH3OH)完全反应生成CO2时,有___________mol电子发生转移。
用A、B两种常见化合物组成的混合物,其焰色反应均呈黄色,相互转化关系如图(其他物质均已略去)。
完成下列问题:
(1)化学式:A______________________,C______________________________。
(2)B加热产生D的化学方程式为____________________。B加稀硫酸产生D的离子方程式为______________________________。
(3)A、B加热后,若只得到一种固体化合物,则A与B的物质的量之比的最大值为__________(填数字)。
A、B、C是周期表中短周期元素组成的三种常见化合物,甲、乙、丙是三种单质,这些单质和化合物之间存在如下的关系: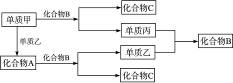
试完成下列空白:
(1)A、B、C的化学式分别为__________、__________、__________。
(2)单质甲与化合物B反应的离子方程式为:______________________________。
(3)在A、B、C三种化合物中,必定含有的元素是__________(用甲、乙、丙表示)。
现有A、B、C、D四种化合物,透过蓝色钴玻璃其焰色反应均为紫色,A、B、C和盐酸反应后,均可得到D;将固体C加热可制得A;若在A的溶液中通入一种无色无味气体,又可制得C;若B与C的溶液混合可制得A。
(1)推断A是________________,B是____________,C是___________,D是____________。
(2)写出B+C A的离子方程式:______________________。
A的离子方程式:______________________。
学生甲用钠与过量的水反应得到1 g H2和溶液M,乙分别用Fe、Zn、Al与过量的盐酸(与甲所用的水质量相同)制取1 g H2,分别得到三种溶液N、P、Q,则M、N、P、Q四种溶液的质量从大到小的顺序是()
| A.M、N、P、Q | B.P、N、M、Q | C.M、P、Q、N | D.P、N、Q、M |
为测定钠的相对原子质量,某同学设计了如图2-3所示的反应装置,现有如下步骤:①称量A、B的总质量②称取一定质量的钠③将钠投入锥形瓶中并迅速塞紧带U形干燥管的橡皮塞④用镊子取金属钠并用滤纸吸干煤油。有关数据是:称取的金属钠质量为a g,A、B反应前总质量为b g,反应后A、B的总质量为c g。请根据题意完成下列问题:
图2-3
(1)实验步骤的顺序应为(填序号)。
(2)用a、b、c表示的钠的相对原子质量为。
(3)下列因素对实验结果分别有何影响(填“偏大”或“偏小”)?
①没有B装置:。
②用金属钠时未吸干煤油:。
③称得的金属钠表面变暗后才放入锥形瓶:。
④反应时,钠燃烧起来:。