I.碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应: W(g)+ I2(g) WI2(g)
WI2(g)
为模拟上述反应,在实验室中准确称取0.508 g 碘、0.736 g金属钨放置于50.0mL密闭容器中,并加热使其反应。下图一是混合气体中的WI2蒸气的物质的量随时间变化关系的图像[n(WI2) ~ t]
其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
请回答下列问题:
(1)该反应是 (填写“放热”“吸热”)反应。
(2)反应从开始到t1(t1=" 3" min)时间内的平均速率υ(I2)= mol/(L.min)。
(3)在450℃时,计算该反应的平衡常数K= 。
(4)能够说明上述反应已经达到平衡状态的有 。
| A.I2与WI2的浓度相等 |
| B.单位时间内,金属钨消耗的物质的量与单质碘生成的物质的量相等 |
| C.容器内混合气体的密度不再增加 |
| D.容器内气体压强不变化 |
Ⅱ.图中甲为甲醇燃料电池(电解质溶液为KOH溶液),该同学想在乙中实现铁上镀铜,则a处电极上发生的电极反应式是 。
Ⅲ.已知:H2(g)、CO(g)和CH3CH2OH(l)的燃烧热分别为285.8 kJ·mol-1、283.0 kJ·mol-1和1365.5 kJ·mol-1。反应 2CO(g)+4H2(g) CH3CH2OH(l)+H2O(l) 的△H= 。
CH3CH2OH(l)+H2O(l) 的△H= 。
海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下: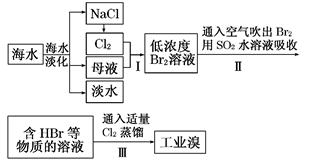
(1)请列举海水淡化的两种方法:________、________。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、________、________或H2、________。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为____________________________________________________________________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为
________________________________________________________________________。
由此反应可知,除环境保护外,在工业生产中应解决的主要问题是_________________________________________________________________。
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图: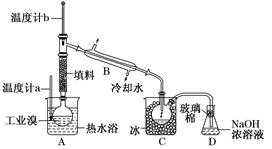
请你参与分析讨论:
①图中仪器B的名称________。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是____________________________________________________________。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件________________________________________________________________________。
工业上用铝土矿(成分为氧化铝、氧化铁)制取铝的流程如下: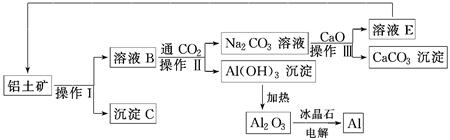
请回答下列问题。
(1)操作Ⅰ、操作Ⅱ、操作Ⅲ都用到的玻璃仪器有________________________________。
(2)写出由溶液B生成Al(OH)3的离子方程式:_________________________________________________________。
(3)工艺流程中涉及氧化还原反应的化学方程式为______________________________________________________________________。
(4)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有________(填化学式)。用此法制取铝的副产品是________(填化学式)。
某自来水厂利用河水处理成自来水的工艺流程示意图如下图所示: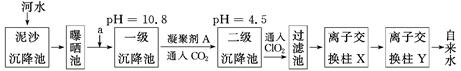
提供的试剂:饱和Na2CO3溶液、NaOH溶液、生石灰、CCl4、BaCl2溶液、KOH溶液
(1)为除去水中含有的Ca2+、Mg2+、HCO3-、Cl-、SO42-,试剂a代表两种化学物质,主要是除去水中SO42-、Mg2+和HCO3-,这两种试剂是________和________(只填化学式)。
(2)凝聚剂A常用FeSO4·7H2O,最终生成红褐色胶体沉淀,该胶状沉淀的化学式为________,可以除去其中的悬浮固体颗粒,该过程是________(填序号)。
A.只有物理变化,无化学变化
B.只有化学变化,无物理变化
C.既有化学变化,又有物理变化
(3)通入CO2的目的是__________和__________。
(4)传统的氧化剂是Cl2,现代工艺用ClO2取代Cl2,通入ClO2的作用是________________________;优点是________________________________。
(5)离子交换柱X、Y中有一种是H+型交换柱,另一种是OH-型离子交换柱,目的是除去水中残留的杂质离子,则X应是哪种交换柱?________(填“H+型”或“OH-型”);如果两个交换柱位置颠倒会产生什么后果?_______________________________________
________________________________________________________________________。
化学在材料的发展过程中起着很重要的作用,2012年度国家最高科学技术奖授予郑哲敏院士、王小谟院士,两人均在材料方面作出了巨大贡献,为国家创造出较大的经济效益。
(1)石灰石、生石灰和熟石灰均是重要的化工原料,下列工业生产中,不可能用到上述原料的是________(填序号)。
①炼铁;②炼钢;③从海水中提取镁;④铝的冶炼;⑤制水泥;⑥制玻璃;⑦制漂白粉;⑧烧制陶瓷
(2)神州八号与天宫一号的成功对接与分离,标志着我国航天工业发展进入了新阶段。下列选项中的描述与化学研究领域无关的是________。
| A.燃料燃烧为神州八号升空提供动力 |
| B.与地面指挥中心联系的无线电通讯 |
| C.宇航服使用的合成纤维等新材料 |
| D.太空舱中利用NiFeO4处理呼出的废气 |
(3)玻璃钢是将玻璃纤维和高分子材料复合而成的复合材料,它具有强度高、质量轻、耐腐蚀、抗冲击、绝缘性能好等优良性能,其中基体是__________,增强体是________。
(4)橄榄石型LiFePO4是一种锂离子电池正极材料,其中Fe元素显+2价。常向LiFePO4中加入少量活性炭黑,其作用除了可以改善LiFePO4的导电性能外,还能____________________。
水处理技术在生产、生活中应用广泛。
(1)工业上常用绿矾作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH调到9左右,再加入绿矾。请解释这一做法的原因:_______________________________________________________________________。
(用必要的离子方程式和文字做答)
(2)根据水中Ca2+、Mg2+的多少,把天然水分为硬水和软水,硬水必须经过软化才能使用。①硬水软化的方法通常有________、________和离子交换法。离子交换树脂使用一段时间后,逐渐由NaR型变为CaR2(或MgR2)型,而失去交换能力。把CaR2(或MgR2)型树脂置于________中浸泡一段时间,便可再生。
②当洗涤用水硬度较大时,洗衣粉与肥皂相比,________洗涤效果较好,原因是________________________________________________________________________。
(3)我国某地苯胺大量泄漏于生活饮用水的河道中,当地采取的应急措施之一是向河水中撒入大量的活性炭,活性炭的作用是________________________________________。
(4)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理。首先在硝化细菌作用下将NH4+氧化为NO3-:________NH4++________O2=________NO3-+________H++______H2O,然后,加入甲醇与NO3-生成N2:______NO3-+______CH3OH=________N2↑+________CO2↑+________H2O+________OH-。
试配平以上两个离子方程式。