下列对浓H2 SO4 的叙述正确的是
| A.常温下,浓H2SO4 与铁、铝不反应,所以铁质、铝质容器能盛放浓H2 SO4 |
| B.浓H2 SO4 具有吸水性,能使蔗糖炭化 |
| C.浓H2 SO4 和铜片加热既表现出酸性,又表现出氧化性 |
| D.浓H2 SO4 与亚硫酸钠反应制取H2 SO3 时,浓H2 SO4 表现出强氧化性 |
为探究NaHCO3、Na2CO3和盐酸(以下盐酸浓度均为1 mol·L-1)反应过程中的热效应,实验测得如下数据:
| 序号 |
35 mL试剂 |
固体 |
混合前 温度/℃ |
混合后 温度/℃ |
| ① |
水 |
2.5 g NaHCO3 |
20.0 |
18.5 |
| ② |
水 |
3.2 g Na2CO3 |
20.0 |
24.3 |
| ③ |
盐酸 |
2.5 g NaHCO3 |
20.0 |
16.2 |
| ④ |
盐酸 |
3.2 g Na2CO3 |
20.0 |
25.1 |
由此得出的结论正确的是
A.Na2CO3溶液与盐酸的反应是吸热反应
B.NaHCO3溶液与盐酸的反应是放热反应
C.20.0 ℃时,含3.2 g Na2CO3的饱和溶液和35 mL盐酸混合后的温度将低于25.1 ℃
D.20.0 ℃时,含2.5 g NaHCO3的饱和溶液和35 mL盐酸混合后的温度将低于16.2 ℃
聚乙炔衍生物分子M的结构简式及M在稀硫酸作用下的水解反应如图所示。下列有关说法不正确的是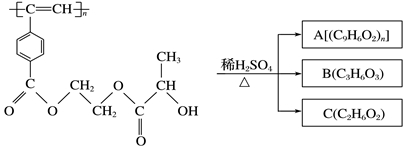
M
A.M与A均能使酸性高锰酸钾溶液和溴水褪色
B.B能发生消去、氧化、取代、缩聚等反应
C.1 mol M与足量烧碱溶液反应,可消耗2n mol NaOH
D.A、B、C各1 mol分别与金属钠反应,放出气体的物质的量之比为1∶2∶2
n L三种气态烃混合物与足量氧气混合点燃后,恢复到原来状态(常温常压),体积共缩小2n L,这三种烃不可能的组合是
| A.CH4、C2H4、C3H4以任意比混合 |
| B.C2H6、C4H6、C2H2以2:1:2的物质的量之比混合 |
| C.C3H8、C4H8、C2H2以11:14:26的质量之比混合 |
| D.CH4、C3H6、C2H2以a:b:b体积比混合 |
贝诺酯是由阿司匹林、扑热息痛经化学法拼合制备的解热镇痛抗炎药,其合成反应式(反应条件略去)如下: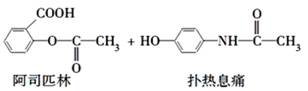
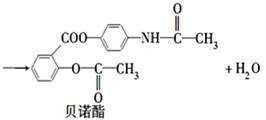
下列叙述错误的是
| A.FeCl3溶液可区别阿司匹林和扑热息痛 |
| B.1 mol阿司匹林最多可消耗2 mol NaOH |
| C.常温下贝诺酯在水中的溶解度小于扑热息痛 |
| D.C6H7NO是扑热息痛发生类似酯水解反应的产物 |
如下a、b、c、d、e、f是六种有机物,其中a是烃类,其余是烃的衍生物,下列有关说法不正确的是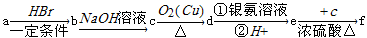
| A.若a的相对分子质量是42,则d是丙醛 |
| B.若d的相对分子质量是44,则a是乙炔 |
| C.若a为苯乙烯(C6H5—CH=CH2),则f的分子式是C16H16O2 |
| D.若a为单烯烃,则d与f的最简式一定相同 |